
2、cos(-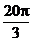 )的值是
( )
)的值是
( )
A.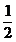 B.-
B.-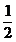 C.
C.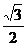 D.-
D.-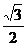
1、某地区有300家商店,其中大型商店有30家,中型商店有75家,小型商店有195家. 为了掌握各商店的营业情况,要从中抽取一个容量为20的样本. 若采用分层抽样的方法,抽取的中型商店数是 ( )
A. 2 B.5 C.3 D. 13
25.(10分)把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4 X(g)+5 Y(g)=n Z(g)+6 W(g)。2 min 末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:
(1)前2 min内用X的浓度变化表示的平均反应速率;
(2)2 min末时Y的浓度;
(3)化学反应方程式中n的值是多少?
24. (11分)下表是某兴趣小组通过实验获得的稀硫酸与某金属反应的实验数据:
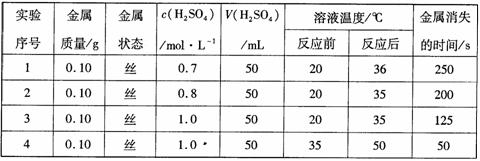
分析上述数据,回答下列问题:
(1)该金属与稀硫酸进行的反应属于
A. 放热反应 B. 复分解反应 C. 氧化还原反应 D. 离子反应 E. 置换反应
(2)实验1、2可得出的结论是 ;实验3、4可得出的结论是 。
(3)如果将实验用的金属丝先浸入硫酸铜溶液一段时间后,再取出进行上述实验4,则反应需要的时间应 (填“>”或“<”)50s,你认为比较合理的解释是: 。
(4)若将该金属与铁用导线连接,插入盛有稀硫酸的烧杯中制作成原电池,观察到铁的表面有大量气泡。该金属的金属活动性比铁 (选填“强”或“弱”),铁在该原电池中作 极。
23. (11分)A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平。D是一种日常生活中常用的调味品。A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略)。


(1)工业上,由石油获得石蜡油的方法是 ;
(2)丁烷是由石蜡油获得A过程中的中间产物之一,它的一种同分异构体中含有三个甲基,写出这种同分异构体的结构简式: ;
(3)B、D分子中官能团的名称分别是 、 ;
A→B的反应类型是 ;
写出反应B→C的化学方程式: ;
(4)大多数的有机反应速率比较缓慢,我们在实验或生产中为了提高有机反应的速率,通常采取的措施有 (填一项即可)。
22.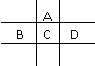 (10分)有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如右图所示。E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同。
(10分)有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如右图所示。E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同。
请回答下列问题:
(1)B元素在周期表中的位置为 ;
(2)A与氢元素能形成原子物质的量之比为1:1的化合物,其电子式为 ;
(3)向D与E形成的化合物的水溶液中滴入NaOH溶液直至过量,观察到的现象是 ,最后阶段反应的离子方程式为 ;
(4)B、C、D、E的最高价氧化物的水化物的酸性从强到弱的顺序为(物质用化学式表示) 。
21. (8分)(1)下列变化:①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。(填序号)
化学键没有被破坏的是 ;仅发 生离子键破坏的是___ 仅发生离子键破坏的是 ;既发生离子键又发生共价键破坏的是 ______。
生离子键破坏的是___ 仅发生离子键破坏的是 ;既发生离子键又发生共价键破坏的是 ______。
(2)已知拆开1 mol H-H键、1 mol N≡N、1 mol N-H键分别需要吸收的能量为436kJ、946k J、391k J。则由N2和H2反应生成1 mol NH3
需要 (填“放出”或“吸收”) 的热量。
20.关于下列图示的说法中正确的是( )
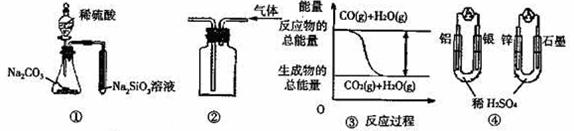
A.用图 ① 所示实验可比较硫、碳、硅三种元素的非金属性强弱
B.用图 ② 所示实验装置排空气法收集CO2气体
 C.图
③ 表示CO(g)+H2O(g) CO2(g)+H2(g)为吸热反应
C.图
③ 表示CO(g)+H2O(g) CO2(g)+H2(g)为吸热反应
D.图 ④ 两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同
第Ⅱ卷(非选择题,共50分)高*考
19. CO和H2在一定条件下可以合成乙醇:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
A.CO全部转化为乙醇
B.正反应和逆反应的化学反应速率均为零
C.CO和H2以1∶2的物质的量之比反应生成乙醇
D.反应体系中乙醇的物质的量浓度不再变化
18.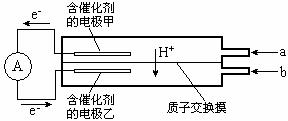 如图是甲醇--空气电池工作时的示意图。甲醇在催化剂作用下提供质子(H+) 和电子,电子经外电路、质子经内电路到达另一极与氧气反应。下列说法中正确的是( )
如图是甲醇--空气电池工作时的示意图。甲醇在催化剂作用下提供质子(H+) 和电子,电子经外电路、质子经内电路到达另一极与氧气反应。下列说法中正确的是( )
A.正极反应式为:2H+ +2e- =H2↑
B.乙电极为电池的负极,b处通入的物质是空气
C.负极反应式为:CH3OH+H2O-6e-=CO2+6H+
D.在电池反应中,每消耗l mol氧气,理论上能生成标准状况下CO2气体22.4L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com