
由于某种原因,一部分电流离开了指定的导体,而在原来不该有电流的导体内流动,这一部分电流,称为杂散电流。它主要来自于电气火车、直流电焊、地下铁道及电解槽等电源的漏电。由杂散电流引起的腐蚀,如在金属制作的电解槽中进行电解时,正常情况下电流应从正极通过电解液流向负极。但也有可能有部分电流先从正极流向靠近正极的金属槽壁,然后从靠近负极的电解壁流出,并通过溶液回到负极.这样,电流在从金属电解槽壁流出之处便成为阳极而遭到腐蚀.又如电气火车顶上有根架空线,其作用是接受从电站正极输入的直流电,经过车厢后从地面铁轨回到电站的负极。如果各段铁轨间连接良好,则大部分电流能通过路轨回到电站.要是路面不平,路轨间连接又不好,而地面又潮湿,这时将有部分电流流入地下,通过埋在路轨下的金属管道或其他金属设施,最后返回路轨到电站的负极。这时,路轨下出现两个串联的大电解池。根据电流的流动方向,一个电解池的阳极是铁轨,阴极是地下管线;另一电解池的阳极是地下管线,阴极是路轨。前者腐蚀的是路轨,暴露在地面上,易被发现,维修也方便;后者腐蚀的是地下管线,不易被发现,且维修也不便,问题更为严重。此外,杂散电流也能引起钢筋混凝土结构的腐蚀,尤其冬季施工,为了防冻而在混凝土中加入氯化物(如NaCl、CaC12),其腐蚀就更为严重。
可见,土壤腐蚀同样既广泛又严重,研究并了解各类土壤的腐蚀规律,其目的在于防腐。
如果土壤中严重缺氧,又无其他杂散电流,按理是较难进行电化学腐蚀的,可是埋在地下了的金属构件照样遭到严重的破坏,有人曾在电子显微镜下观察被土壤腐蚀的金属,发现有种细菌,其形状为略带弯曲的圆拄体,长度约为2 ×10-6m,并长有一根鞭毛。细菌依靠鞭毛的伸曲,使其躯体向前移动。由于它依赖于硫酸盐还原反应而生存的,所以人们称它为硫酸盐还原菌。它对金属腐蚀作用的解释,率先由屈菲(Kuhv)提出,在缺氧条件下,金属虽然难以发生吸氧腐蚀,但可进行析氢腐蚀(电化学腐蚀中,有氢气放出)。只是因阴极上产生的原子态的氢未能及时变为氢气析出,而被吸附在阴极表面上,直接阻碍电极反应的进行,使腐蚀速率逐渐减慢。可是,多数的土壤中都含有硫酸盐。如果有硫酸盐还原菌存在,它将产生生物催化作用,使SO42-离子氧化被吸附的氢,从而促使析氢腐蚀顺利进行。整个过程的反应如下:
阳极 4Fe-8e = 4Fe2+
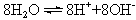
阴极 8H++8e=8H(吸附在铁表面上)
SO42-+8H S2-+4H2O
S2-+4H2O
Fe2++S2- = FeS(二次腐蚀产物) +)3Fe2++6OH- = Fe(OH)2(二次腐蚀产物) ___________________________________________ 总反应:4Fe+SO42-+4H2O = FeS+3Fe(OH)2+2OH-
其腐蚀特征是造成金属构件的局部损坏,并生成黑色而带有难闻气味的硫化物。硫酸盐还原菌便是依靠上述化学反应所释放出的能量进行繁殖的。
据目前研究,能参与金属腐蚀过程的细菌不止一种,它们并非本身使金属腐蚀,而是细菌生命活动的结果间接地对金属电化学腐蚀过程产生的影响。例如,有的细菌新陈代谢能产生某些具有腐蚀性的物质(如硫酸、有机酸和硫化氢等),从而改变了土壤中金属构件的环境;有的细菌能催化腐蚀产物离开电极的化学反应,致使腐蚀速率加快。此外,许多细菌还能分泌粘液,这些粘液与土壤中的土粒、矿物质、死亡细菌、藻类以及金属腐蚀产物等粘合并形成粘泥,覆盖在金属构件的表面,因局部缺氧成为差异充气电池的阳极,从而遭到严重的孔腐蚀。
腐蚀性细菌一般分为喜氧性菌(又称嗜氧性菌)和厌氧性菌两大类。增氧性菌必须在有游离氧的环境中生存,如喜氧性氧化铁杆菌,它依靠金属腐蚀过程中所产生的Fe2+氧化成Fe3+时所释放的能量来维持其新陈代谢,它存在于中性含有有机物和可溶性铁盐的水、土壤及锈层中,其生长温度为20-25℃,pH在7- 7.4 之间。又如喜氧性排硫杆菌,能将土壤中的污物发醇所产生的硫代硫酸盐还原为硫元素;而喜氧性氧化硫杆菌又可把元素硫氧化为硫酸,从而加快金属的腐蚀。这类细菌常存在于土壤、污水及泥水中,其生长温度为28-30℃,PH为2.5-3.5。
厌氧性菌必须在缺乏游离氧的条件下才能生存,如硫酸盐还原菌是种常见的厌氧性菌.它是地球上最古老的微生物之一,其种类繁多,广泛存在于中性的土壤、河水、海水.油井、港湾及锈层中,它们的共同特点是把硫酸盐还原为硫化物,生长适宜温度为30℃,PH在7.2-7.5.
喜氧性菌和厌氧性菌虽然生存条件截然不同,但往往在喜氧性菌腐蚀产物所造成的局部缺氧的环境中,厌氧性菌亦可以得到繁殖的机会,这种不同性质细菌的联合腐蚀常发生于水管内壁,在那里,首先是氧化铁杆菌将水管腐蚀溶解下来的Fe3+,并形成Fe(OH)3沉淀,其沉淀附着在水管内壁生成硬壳状的锈瘤。瘤下的金属表面缺氧,恰好为硫酸盐还原菌提供生存与繁殖的场所。这样,两类细菌相辅相成,更加快了瘤下金属的溶解。有人取下锈瘤,经分析发现其中的腐蚀产物含有1.5%-2.5%的硫化物,每克腐蚀产物中约含有1000条硫酸盐还原菌。
此外,还有一些腐蚀性细菌不论有氧或无氧的环境中均能生存,如硝酸盐还原菌,能把土壤中的硝酸盐还原为亚硝酸盐和氨。它的生长温度为27℃,pH为5.5-8.5。
如今发现,由微生物引起的腐蚀广泛地存在于地下管道、矿井、海港、水坝以及循环冷却系统的金属构件和设备中,给冶金、电力、航海、石油及化工等行业带来极大的损失.因此,近十多年来,对如何控制微生物腐蚀的研究日益引起有关部门的高度重视,越来越多的人从事这方面的考察与研究,已取得了可喜的进展。
由于氧气分布不均匀而引起的金属腐蚀,称为差异充气腐蚀。土壤的固体颗粒含有砂子、 灰、泥渣和植物腐烂后形成的腐植土。在土壤的颗粒间又有许多弯曲的微孔(或称毛细管),土壤中的水分和空气可通过这些微孔而深入到土 壤中的水分和空气可通过这些微孔而深入到土壤内部,土壤中的水分除了部分与土壤的组分结合在一起,部分粘附在土壤的颗粒表面,还有一部分可在土壤的微孔中流动。于是,土壤的盐类就溶解在这些水中,成为电解质溶液,因此,土壤湿度越大含盐量越多,土壤的导电性就越强。此外,土壤中的氧气部分溶解在水中,部分停留在土壤的缝隙内,土壤中的含氧量也与土壤的湿度、结构有密切关系,在干燥的砂土中,氧气容易通过,含氧量较高;在潮湿的砂土中, 氧气难以通过,含氧量较低.;在潮湿而又致密的粘士中,氧气的通过就更加困难,故含氧量最低。埋在地下的各种金属管道,如果通过结构和干湿程度不同的土壤将会引起差异充气腐蚀,假如,铁管部分埋在砂士中,另一部分埋在粘土中,由腐蚀电池
阳极 Fe-2e®Fe2+
阴极 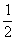 O2+H2O+2e®2OH-
O2+H2O+2e®2OH-
不难看出,因砂土中氧的浓度大于粘士中氧的浓度,则在砂土中更容易进行还原反应,即在砂土中铁的电极电势高于在粘土中铁的电极电势,于是粘土中铁管便成了差异充气电池的阳极而遭到腐蚀。同理,埋在地下的金属构件,由于埋设的深度不同,也会造成差异充气腐蚀,其腐蚀往往发生在埋得深层的部位,因深层部位氧气难以到达,便成为差异充气电池的阳极,那些水平放置而直径较大的金属管,受腐蚀之处亦往往是管子的下部,这也是由差异充气所引起的腐蚀。
重要的钛化合物有:二氧化钛(TiO2)、四氯化钛(TiCl4)、偏钛酸钡(BaTiO3)。
纯净的二氧化钛是白色粉末,是优良的白色颜料,商品名称“钛白”。它兼有铅白(PbCO3)的遮盖性能和锌白(ZnO)的持久性能。因此,人们常把钛白加在油漆中,制成高级白色油漆;在造纸工业中作为填充剂加在纸桨中;纺织工业
中作为人造纤维的消光剂;在玻璃、陶瓷、搪瓷工业上作为添加剂,改善其性能;在许多化学反应中用作催化剂。在化学工业日益发展的今天,二氧化钛及钛系化合物作为精细化工产品,有着很高的附加价值,前景十分诱人。
四氯化钛是一种无色液体;熔点250K、沸点409K,有制激性气味。它在水中或潮湿的空气中都极易水解,冒出大量的白烟。
TiCl4+3H2O == H2TiO3+4HCl
因此TiCl4在军事上作为人造烟雾剂,犹其是用在海洋战争中。在农业上,人们用TiCl4形成的浓雾复盖地面,减少夜间地面热量的散失,保护蔬菜和农作物不受严寒、霜冻的危害。
将TiO2 和BaCO3 一起熔融制得偏钛酸钡:
TiO2+BaCO3 == BaTiO3十CO2
人工制得的BaTiO3具有高的介电常数,由它制成的电容器有较大的容量,更重要的是BaTiO3 具有显著的“压电性能”,其晶体受压会产生电流,一通电,又会改变形状。人们把它置于超声波中,它受压便产生电流,通过测量电流强弱可测出超声波强弱。几乎所有的超声波仪器中都要用到它。随着钛酸盐的开发利用,它愈来愈广泛地用来制造非线性元件、介质放大器、电子计算机记忆元件、微型电容器、电镀材料、航空材料、强磁、半导体材料、光学仪器、试剂等。
钛、钛合金及钛化合物的优良性能促使人类迫切需要它们。然而,生产成本之高,使应用受到限制。我们相信在不久的将来,随着钛的治炼技术不断改进和提高,钛、钛合金及钛的化合物的应用将会得到更大的发展。
纯钛是银白色的金属,它具有许多优良性能。钛的密度为4.54g/cm3,比钢轻43% ,比久负盛名的轻金属镁稍重一些。机械强度却与钢相差不多,比铝大两倍,比镁大五倍。钛耐高温,熔点1942K,比黄金高近1000K ,比钢高近
500K。
钛属于化学性质比较活泼的金属。加热时能与O2、N2、H2、S和卤素等非金属作用。但在常温下,钛表面易生成一层极薄的致密的氧化物保护膜,可以抵抗强酸甚至王水的作用,表现出强的抗腐蚀性。因此,一般金属在酸、碱、盐的溶液中变得千疮百孔而钛却安然无恙。
液态钛几乎能溶解所有的金属,因此可以和多种金属形成合金。钛加入钢中制得的钛钢坚韧而富有弹性。钛与金属Al、Sb、Be、Cr、Fe等生成填隙式化合物或金属间化合物。
钛合金制成飞机比其它金属制成同样重的飞机多载旅客100多人。制成的潜艇,既能抗海水腐蚀,又能抗深层压力,其下潜深度比不锈钢潜艇增加80% 。同时,钛无磁性,不会被水雷发现,具有很好的反监护作用。
钒具有“亲生物“’性。在人体内,能抵抗分泌物的腐蚀且无毒,对任何杀菌方法都适应。因此被广泛用于制医疗器械,制人造髋关节、膝关节、肩关节、胁关节、头盖骨,主动心瓣、骨骼固定夹。当新的肌肉纤维环包在这些“钛骨”上时,这些钛骨就开始维系着人体的正常活动。
钛在人体中分布广泛,正常人体中的含量为每70kg体重不超过15mg,其作用尚不清楚。但钛能刺激吞噬细胞,使免疫力增强这一作用已被证实。
钛在1791年被发现,而第一次制得纯净的钛却是在1910年,中间经历了一百余年。原因在于:钛在高温下性质十分活泼,很易和氧、氮、碳等元素化合,要提炼出纯钛需要十分苛刻的条件。
工业上常用硫酸分解钛铁矿的方法制取二氧化钛,再由二氧化钛制取金属钛。浓硫酸处理磨碎的钛铁矿(精矿),发生下面的化学反应:
FeTiO3+3H2SO4 == Ti(SO4)2+FeSO4+3H2O FeTiO3+2H2SO4 == TiOSO4+FeSO4+2H2O FeO+H2SO4 == FeSO4+H2O Fe2O3+3H2SO4 == Fe2(SO4)3+3H2O
为了除去杂质Fe2(SO4)3,加入铁屑,Fe3+ 还原为Fe2+,然后将溶液冷却至273K以下,使得FeSO4·7H2O(绿矾)作为副产品结晶析出。
Ti(SO4)2和TiOSO4水解析出白色的偏钛酸沉淀,反应是: Ti(SO4)2+H2O == TiOSO4+H2SO4 TiOSO4+2H2O == H2TiO3+H2SO4
锻烧偏钛酸即制得二氧化钛: H2TiO3 == TiO2+H2O
工业上制金属钛采用金属热还原法还原四氯化钛。将TiO2(或天然的金红石)和炭粉混合加热至1000-1100K,进行氯化处理,并使生成的TiCl4,蒸气冷凝。
TiO2+2C+2Cl2=TiCl4+2CO
在1070K 用熔融的镁在氩气中还原TiCl4可得多孔的海绵钛:
TiCl4+2Mg=2MgC12+Ti
这种海绵钛经过粉碎、放入真空电弧炉里熔炼,最后制成各种钛材。
钛在地壳中的丰度为0.63% ,居元素分布序列中的第十位,仅次于氧、硅、铝、铁、钙、钠、钾、镁、氢,比常见的锌、铅、镍、铜的总和还要多16倍,但大部分处于分散状态。主要的矿物有金红石(TiO2)和钛铁矿(FeTiO3)组成复杂的钒钛铁矿。我国钛蕴藏量居全球之首,仅四川攀枝花地区的矾钛铁矿,储量约15亿吨,占全国已探明储量的97% 。
早在1791年,英国门那新(Meneccin)山谷中静静地躺着一种黑色的矿砂,无人问津。牧师格利高尔(w.Gregor)是位矿物学的爱好者,当他在自己的教区内游览时,发现并带回了这种黑色的东西,经过分析,他宣称找到了一种未知的新金属。为了纪念黑色矿砂的发现地,格利高尔把这种金属称为Menaccin,把矿砂称为门那新矿(Menaccite),也就是现在所说的钛铁矿(FeTiO3)
1795年,德国科学家克拉普罗兹(铀的发现者)从匈牙利带回的矿物中成功地分离出一种新元素的氧化物,并很快确定他和格利高尔发现的是同一种元素。这种矿物就是钛的氧化物-金红石(TiO2)。
克拉普罗兹把此元素命名为titanium(钛)取自神话中的“泰坦”(Titans),意指大地之神的儿子。
由于砷化镓半导体材料的出现,使人们进一步加强了对砷的有用性的认识。然而随着砷矿的开来,砷化物的生产、研制和使用的扩大,砷对环境的影响也更加令人关注。表2列出了我国对砷化物在环境中的最高容许量(GB5749-85),如果超标,应及时治理,否则会污染环境,危及人类的健康。
表2 砷化物在环境中的最高容许量
|
大气 |
0.003mg/m3(日平均) |
|
地面水 |
0.05mg/L |
|
饮用水 |
0.04mg/L |
|
土壤 |
15mg/kg |
|
排放废水 |
0.5mg/L |
|
灌溉水 |
0.05mg/L |
农业生产上,信石、砒霜等是最早用于防治飞螟、蝼蛄、地老虎等害虫的无机砷杀虫剂。1892年人们又发现砷酸铅(PbHAsO4)能有效防治舞毒蛾,并于1906年首先在美国工业化,在美国又制出了砷酸钙[Ca3(AsO4)2],1924年开始大量生产,用于防治棉花害虫及多种咀口器害虫。但此类农药随着六六六、滴滴涕其他杀虫剂的问世,加之砷、铅等的毒性,使用量逐渐减少。
1956年德国Bayer公司首先开发出有机杀菌剂-福美甲胂(Urbazid)(式1)用于治水稻纹枯病,它还能防治果树、棉花、烟草多种作物的病害,但因其对稻类有药害,故制成复合剂使用。此外还有福美胂(式2)、甲硫化胂[(CH3AsS)3]
、甲基砷酸铁铵[(CH3AsO3)FeNH4]等,由于它们对多种植物病害的防治有着良好的效果,故曾使用了很长时期。
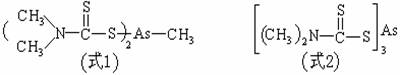
这婴农药进入菌体后,由于能代谢成氧化亚砷的衍生物(R-As=O),故能与组织中的蛋白质及酶分子中的SH基结合,而起到毒杀作用。
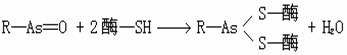
然而这类含砷杀菌剂和含砷杀虫剂一样,由于它对人、畜的剧毒性,故在1996年,我国化工部已经把它们列人限制生产和使用的农药目录之中。
在医药方面,中医早就把雄黄用作杀虫和解毒药,外用治疗癣疥,内服治疗中风、小儿惊风等症。13世纪开始,我国又用砒霜或砒石(FeAsS)等含砷药物驱除梅毒,治疗性病取得了良好效果,在国外,由于砷化物对细胞的破坏,特别对亚急性肿瘤敏感,故曾用亚砷酸钾治疗慢性白血病和何杰金氏病(Hodgiki d.)(淋巴网状细胞瘤)。1905年,人们又发现氨基苯砷酸钠[atoxyl;NH2C6H4AsO(OH)2] 对治
疗人的锥虫病有显著疗效。
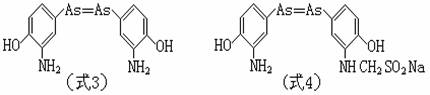
应当特别提出的是,1907年,艾利希(Ehrlich P.)及其同事,经过长期试验和研究,发明了六O六(亦称洒尔佛散或胂凡纳明)(式3),它是一种对梅毒及其他螺旋体病有特效,而且比较安全的新药,这在当时医学界上是一项重大成就,开创了化学治疗的先例。艾利希不但创造了“化学治疗”一词,并阐明了这种药物的治疗作用,在于它在体内代谢成的氧苯胂
[C6H5AsO]能与寄生在体内的梅毒菌体的SH基反应,起到毒杀用。此后又改进制成使用更方便的九一四(亦称新洒尔佛散或新胂凡纳明)(式4):
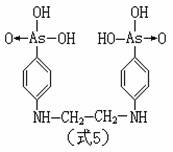
近年来,这类药物虽然相继被更安全、有效的抗菌素所代替,但是含砷药物的研制并未停止。如在80年代出现的,能通过口服在肠内有效地杀死阿米巴的苯砷酸[C6H5AsO(OH)2]
衍生物,治疗寄生虫感染的驱虫剂滴芬塔胂(式5)等:
随着电子工业的发展,使得砷化镓(GaAs)、砷化铟(InAs)等金属间化合物,作为半导体材料的需要急剧增加,尤其是(GaAs及GaAsxPx-1),作为半导体激光器,用于通讯、医学、电脑、精加工、激光雷达等多方面,随着砷化镓制备技术的提高,相继制出了纯度更高的砷化镓半导体,这种材料不但能极大地提高电子运行速度,而且由于它抵抗外层空间辐射的能力比硅强,故更适用于在卫星等航空器上使用,进一步推动电子通讯技术的发展。
此外,三氧化二砷还大量用于玻璃制造上的脱泡剂和消色剂。将金属砷添加至铜或铅中,可以提高它们的加工硬度和耐腐蚀性。用砷的硫化物、硒化物加在玻璃中,制成的可透过红外线的玻璃,用作红外光谱仪、红外照相机等镜头材料。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com