
4.在一定条件下,可实现下列物质间的转化,转化过程如下图所示,
请回答相关问题:

(1)A是______B是______C是______(请填写化学式)
(2)反应①的化学方程式为:____________________________________________。
(3)反应③的化学方程式为:____________________________________________。
(4)反应④的化学方程式为:____________________________________________。
【答案】(1)Fe 、Cl2 、H2; (2)2Fe + 3Cl2 ==2FeCl3;
(3)Fe + 2HCl ==FeCl2 + H2↑; (4)2FeCl2 + Cl2 ==2FeCl3
【解析】由B为黄绿色气体且为单质,可知B为Cl2;由框图可知反应①中生成的固体D为固体单质A与Cl2反应生成的一种氯化物;反应②中生成的E为Cl2与气体单质C 生成的一种可溶于水的氯化物,且E溶液和固体单质A又可以重新生成气体C和F,只有当C为H2,F为一种氯化物时才能满足这一过程;而A与Cl2反应已生成了一种氯化物D,F又是一种氯化物,所以A为变价金属,应为Fe。
3.室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下面框图进行反应。又知E溶液是无色的,请回答:
【解析】本题是一道综合性很强的推断题,它以等电子微粒结构与性质有机结合起来有效的考查综合分析能力,同时具有一定的开放性(填CO的用途)。解答本题的突破口是“丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体”,而丙为负二价双原子的离子,且电子总数为14,根据中学化学课本上介绍的两种负二价阴离子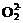 和
和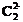 ,可知丙为
,可知丙为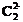 。电子总数为14的原子是硅原子。由相同元素组成的双原子分子为N2。乙在高温下是一种还原剂且为14个电子,则乙为CO,CO在工业上主要是冶炼金属如炼铁等。
。电子总数为14的原子是硅原子。由相同元素组成的双原子分子为N2。乙在高温下是一种还原剂且为14个电子,则乙为CO,CO在工业上主要是冶炼金属如炼铁等。

 (2)Fe2O3 +3CO
(2)Fe2O3 +3CO 2Fe + 3CO2
2Fe + 3CO2
(3)N2 +O2 2NO (4)Si ;(5)金刚石
2.甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
(1)丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学方程式是___________________________________________________。
(2)乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途:____________________________________________________。
(3)在一定条件下,甲与O2反应的化学方程式是:______________________。
(4)丁的元素符号是____,它的原子结构示意图为_________________________。
(5)丁的氧化物的晶体结构与______的晶体结构相似。
【答案】(1)CaC2 + 2H2O ===Ca(OH)2 + C2H2↑
(7)Al(OH)3+OH- AlO2-+2H2O
AlO2-+2H2O
(4) 4HF+O2
4HF+O2
(5)He
(6)NaOH HBrO4 HF
(3)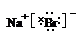
【答案】(1)钠 3
ⅡA 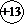
(2)紫黑色
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com