
13.各物质之间的转化关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板。
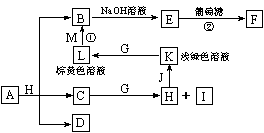
请回答下列问题:
(1)写出A的化学式 ,C的电子式 。
(2)比较Y与Z的原子半径大小: > (填写元素符号)。
(3)写出反应②的化学方程式(有机物用结构简式表示) ,
举出该反应的一个应用实例 。
(4)已知F溶于稀硝酸,溶液变成蓝色,放出无色气体。请写出该反应的化学方程式 。
12.化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为 。
(2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为 。
(3)一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。
①Z与H2O2反应,其产物之一是Y的单质,Y的单质的电子式为 ;Z分子的结构呈 。②A的化学式是 。
(4)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭河导弹上有重要应用),其反应的化学方程式是 。
9.  下列有关化学用语使用正确的是
下列有关化学用语使用正确的是
A.硫原子的原子结构示意图: B.NH4Cl的电子式:
B.NH4Cl的电子式: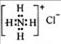
C.原子核内有10个中子的氧原子:
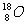
 D.对氯甲苯的结构简式:
D.对氯甲苯的结构简式: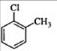
10 .X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
 A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
 B.元素X不能与元素Y形成化合物X2Y2
B.元素X不能与元素Y形成化合物X2Y2
 C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
 D.元素W、R的最高价氧化物的水化物都是强酸
D.元素W、R的最高价氧化物的水化物都是强酸
11 .根据以下事实得出的判断一定正确的是
.根据以下事实得出的判断一定正确的是
 A.HA的酸性比HB的强,则HA溶液pH比HB溶液的小
A.HA的酸性比HB的强,则HA溶液pH比HB溶液的小
 B.A+和B-的电子层结构相同,则A原子的核电荷数比B原子的大
B.A+和B-的电子层结构相同,则A原子的核电荷数比B原子的大
 C.A盐的溶解度在同温下比B盐的大,则A盐溶液的溶质质量分数比B盐溶液的大
C.A盐的溶解度在同温下比B盐的大,则A盐溶液的溶质质量分数比B盐溶液的大
 D.A原子失去的电子比B原子的多,则A单质的还原性比B单质的强
D.A原子失去的电子比B原子的多,则A单质的还原性比B单质的强
8. 下列有关物质性质、结构的表述均正确,且存在因果关系的是:
下列有关物质性质、结构的表述均正确,且存在因果关系的是:
|
|
表述Ⅰ |
表述Ⅱ |
|
A |
在水中,NaCl的溶解度比I2的溶解度大 |
NaCl晶体中C1-与Na+间的作用力大于碘晶体中分子间的作用力 |
|
B |
通常条件下,CH4分子比PbH4分子稳定性高 |
Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小 |
|
C |
在形成化合物时,同一主族元素的化合价相同 |
同一主族元素原子的最外层电子数相同 |
|
D |
P4O10、C6H12O6溶于水后均不导电 |
P4O10、C6H12O6均属于共价化合物 |
6.同一短周期的元素W、X、Y、Z的原子序数依次增加,下列叙述正确的是:
A.单质的化学活泼性:W<X<Y<Z B.原子最外层电子数:W<X<Y<Z
C.单质的氧化能力:W<X<Y<Z D.元素的最高化合价:W<X<Y<Z
7 .门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是:
.门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是:
 A.X单质不易与水反应 B.XO2可被碳或氢还原为X
A.X单质不易与水反应 B.XO2可被碳或氢还原为X
 C.XCl4的沸点比SiCl4的高 D.XH4的稳定性比SiH4的高
C.XCl4的沸点比SiCl4的高 D.XH4的稳定性比SiH4的高
5.下表是元素周期表的一部分,有关说法正确的是
 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
2 |
|
|
|
c |
|
d |
|
|
3 |
a |
b |
|
|
|
e |
f |
A.e的氢化物比d的氢化物稳定 B.a、b、e三种元素的原子半径:e>b>a
C.六种元素中,c元素单质的化学性质最活泼
D.c、e、f的最高价氧化物对应的水化物的酸性依次增强
4.元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
A.同周期元素中X的金属性最强 B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强
3.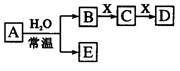 由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如右图转化关系(部分生成物和反应条件略去)。下列推断不正确的是
由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如右图转化关系(部分生成物和反应条件略去)。下列推断不正确的是
A.若X是Na2CO3,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
B.若A是单质,B和D的反应是OH-+HCO3- =H2O+CO32-,则E一定能还原Fe2O3
C.若D为CO,C能和E反应,则A一定为Na2O2,其电子式是

D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
2.甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中各含l8个电子。甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是
A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键
C.丙中含有第2周期ⅣA族的元素,则丙一定是甲烷的同系物
D.丁和甲中各元素质量比相同,则丁中一定含有-l价的元素
1. W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7︰17;X与W 同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是
同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是
A.金属性:Y>Z B.氢化物的沸点:X>W
C.离子的还原性:X>W D.原子及离子半径:Z>Y>X
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com