
4.波尔多液不能用铁制的容器盛放,是因为铁能与农药中的硫酸铜起反应。在该反应中,铁是 ( )
A.是还原剂 B.氧化剂 C.被还原 D.还原产物
3.铁棒与石墨棒用导线连接后,浸入0.01mol·L-1 的食盐溶液中,可能出现的现象是( )
A.铁棒附近产生OH- B.铁棒被腐蚀 C.石墨棒上放出Cl2 D.石墨棒附近产生OH-
2.有一块铝铁合金,将其溶解于足量盐酸中,再加入过量NaOH溶液,在空气中静置至红褐色沉淀不再增加时,将沉淀滤出再灼烧至恒重,得到残留物的质量与原合金质量相同,则合金中铝的质量分数是 ( )
A.22.2% B.30% C.75.5% D.80.6%
1.常温下可盛放浓硫酸的容器是 ( )
A.Na B.Fe C.Al D.Mg
|
1. 2. |
考点1:铁的存在和冶炼
[例1] 钢铁工业是国家工业的基础。2006年我国粗钢产量突破4亿吨,居世界首位。某中学社会实践活动小组利用假期对当地钢铁厂进行了调研,对从矿石开始到钢铁产出的工艺流程有了全面的感性认识。请您对社会实践活动小组感兴趣的问题进行计算:
(1)将6.62 g铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的NaOH 溶液,充分反应后,过滤、洗涤、灼烧得4.80g Fe2O3。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石 吨? (保留两位小数)
(2)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况)。
①计算此钢样粉末中铁和碳的物质的量之比为 。
②再取三份不同质量的钢样粉末分别加到100mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
|
实验序号 |
I |
II |
III |
|
加入钢样粉末的质量/g |
2.812 |
5.624 |
8.436 |
|
生成气体的体积/L(标准状况) |
1.120 |
2.240 |
2.800 |
计算硫酸溶液的物质的量浓度为 。
③若在实验Ⅱ中继续加入mg钢样粉末,计算反应结束后剩余的固体质量为
? (用含m的代数式表示)
[感悟]:
考点2:铁的结构和性质
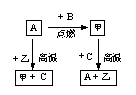 [例2] A、B、C是中学常见的单质。甲、乙两化合物在常温下分别为黑色晶体和无色液体。这些化合物和单质之间的关系如图所示。据此推断:
[例2] A、B、C是中学常见的单质。甲、乙两化合物在常温下分别为黑色晶体和无色液体。这些化合物和单质之间的关系如图所示。据此推断:
(1)若元素A有可变化合价,则单质A的化学式为 。甲的化学式: 。
(2)根据金属活动顺序表判断单质A和单质C活动性强弱:A C(填>或<)。简述甲+CA+乙反应如何才能充分进行? 。
(3)甲还能与另一种常见金属在一定温度下发生反应,并放出大量热,写出该反应的化学方程式: 。
[感悟]:
考点3:铁与酸反应
[例3] 将0.4mol铁粉逐渐加入含硝酸0.8mol的稀硝酸中,反应生成气体的物质的量x随着消耗铁粉的物质的量y的关系如图,正确的是( )
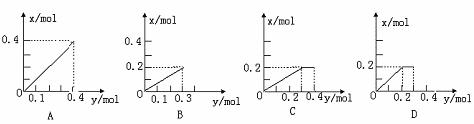
[感悟]:
3.化学性质(较活泼)
铁是较活泼的金属,铁原子的最外层电子数为2个,可失去2个或3个电子而显+2价或+3价,但+3价的化合物较稳定。Fe- = Fe2+ Fe- = Fe3+
(1)Fe →Fe2+:
Fe +S= Fe + CuCl2= ,
Fe + FeCl3 = Fe + H+=
[思考]
把金属铁加入含FeCl3、FeCl2、CuCl2的混合液中充分反应后过滤,滤出不溶物有铜,则滤液中肯定有阳离子 ,肯定不存在阳离子 ,可能有阳离子 (若铁过量呢?)
(2)Fe→Fe3+:
①铁丝在氯气中燃烧:
a.反应原理:
b.现象:铁丝在氯气中燃烧,生成 色的烟。加水振荡后,生成 色溶液
②与强氧化性酸反应:
a.冷的浓HNO3或浓H2SO4使铁发生
b.2.8克铁与160ml 1mol/L稀硝酸作用放出NO气体,则在反应中HNO3共得电子
摩。
(3)Fe →Fe3O4: Fe + H2O == Fe + O2==
归纳:铁的化学性质及在反应后的生成物中显+2价或+3价的规律如下;
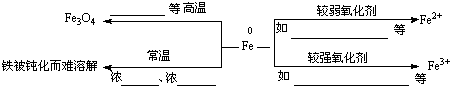
注意:Fe与HNO3等强氧化性物质反应,也有得到Fe2+的可能性(铁过量)
2.物理性质:
(1)纯铁晶体具有 光泽(铁粉为 色)、质地 、密度大,熔沸点高,常用铁含 等杂质,熔点降低,抗蚀力减弱。
(2)具有一般金属的物理通性:具有良好的 、 、 性较好。它还有与其它金属不同的物理性质,它能被 吸引。
1.原子结构:
铁是活泼的 元素,铁位于第 周期第 族,原子结构示意图为: ,电子排布式为: ,价电子排布式为: 常见的化合价有 和
2.铁的冶炼:
金属矿物变成金属的过程,叫做______________。
炼铁的主要原理是 ;
原料: 设备:
赤铁矿炼铁主要反应可用化学方程式 表示;磁铁矿炼铁主要反应可用化学方程式 表示。
主要反应:
尾气主要成分:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com