
9.[江苏省常州市第三中学2009届高三化学11月模拟试卷. ]下列有关物质类别判别的依据中,正确的是[C]
A.原子晶体:晶体的熔点是否很高 B.电解质:水溶液是否导电
C.离子化合物:是否含有离子键 D.酸性氧化物:能否与碱反应
8.[苏州中学2008-2009届第一次月考 ]下列与胶体性质或用途无关的事实是[D ]
①MgCl2能用于止血; ②硅胶能用作吸附剂; ③明矾用于净水; ④在陶瓷、聚合物等材料中加入固态胶体粒子; ⑤药皂里加苯酚能消毒; ⑥三氯化铁溶液中加入氢氧化钠溶液出现红褐色沉淀; ⑦KMnO4溶液通电时阴极区溶液颜色变浅,阳极区溶液颜色加深
A.①②④ B.③⑤⑥ C.④⑤⑥ D.⑤⑥⑦
7.[2009届江苏省苏中四市二区联考高三化学试题]下列叙述正确的是 [D]
A.二氧化硅是人类将太阳能转换为电能的常用材料
B.二氧化硫在接触室被氧化成三氧化硫,再在吸收塔内用水吸收制成浓硫酸
C.为检验酸性溶液中的Cl-和SO42-,先加BaCl2溶液,滤去沉淀后再加AgNO3溶液
D.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
6.[江苏徐州六县一区2009届高三第一学期联考试卷]化学与生产、生活、社会密切相关。下列有关说法中不正确的是[D]
A.2008年北京奥运会开幕式上的“脚印”等焰火让全世界为之欢呼、倾倒,这主要是利用了化学中“焰色反应”的有关知识。
B.神七宇航员所穿航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料。
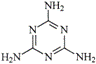 C.三鹿毒奶粉中的三聚氰胺是一种“伪蛋白”,其分子结构如右图所示,其化学式为C3H6N6。
C.三鹿毒奶粉中的三聚氰胺是一种“伪蛋白”,其分子结构如右图所示,其化学式为C3H6N6。
D.2008年诺贝尔化学奖被授予研究“绿色荧光蛋白质”的美籍华裔科学家钱永健等人。蛋白质都是由氨基酸形成的不可降解的高分子化合物,其水溶液有丁达尔效应。
5.[江苏徐州六县一区2009届高三第一学期联考试卷]用NA表示阿伏加德罗常数的值。下列叙述正确的是[C]
A.常温常压下,16g臭氧中含有的氧原子数目为1/3NA
B.标准状况下,2.24L三氧化硫所含的分子数为0.1NA
C.电解精炼铜时,若转移了NA个电子,则阴极析出32 g铜
D.1 mol FeCl3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为NA
4. [江苏省兴化市2008-2009学年高三年级第一学期期中调研 ]下列关于某些物质的检验方法正确的是[CD]
A.利用Ba(OH)2鉴别Na2CO3溶液和NaHCO3溶液
B.用焰色反应鉴别NaCl、KCl和Na2SO4三种物质
C.利用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液
D.通过向瓶中加入适量水观察溶液颜色变化证明一瓶气体是溴蒸气还是二氧化氮
3.[江苏省射阳中学2009届高三第二次月]判断下列有关化学基本概念的依据正确的是[A]
A.氧化还原反应:元素的化合价是否变化
B.胶体:物质的微粒直径是否在1 nm-100 nm之间
C.共价化合物:组成物质的元素是否全部是非金属元素 D.化学变化:是否有热效应、颜色变化、气体或沉淀生成等四种实验现象
2.[江苏省射阳中学2009届高三第二次月]在大试管内依次加入20 mL蒸馏水、10 mL无水酒精、7 g硫酸铵晶体,充分振荡后静 置片刻,形成液体分层、部分固体沉淀的现象; 再用激光笔测试, 仅上层液体出现右图 所示现象。依据上述描述,判断下列说法错误的是[D]
A.硫酸铵的溶解过程属于熵增的过程
B.上层可能是硫酸铵在乙醇中形成的胶体
C.该温度下,硫酸铵在水中的溶解度大于其在乙醇中的溶解度
D.再向该试管内滴入甲基橙试剂振荡后静置,上层液体显无色,下层液体出现红色
1.[江苏省泰州实验中学2008-2009学年度第一学期阶段Ⅱ考试 ]分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④根据反应中的热效应将化学化学反应分为放热反应和吸热反应
A.①② B.③④ C.①③ D.②④
2. 将测定结果与 进行比较,分析产生的 及其原因。如物质的量浓度配制实验,凡是 偏多或 偏小的操作,都会使最终结果偏大。
试题枚举
[例1] (03广东19)要配制浓度约2mol•L-1NaOH溶液100mL,下面操作正确的是
A.称取8g NaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B.称取8g NaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
C.称取8g NaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
D.用100mL量筒量取40mL 5mol•L-1NaOH溶液,倒入250mL烧杯中,再用同一量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
解析 本题考查对“配制一定物质的量浓度”要求的理解 和量筒、容量瓶等计量仪器的使用。根据题目的数据和“约为2 mol•L-1 ”的要求可知,配制的精确度要求较低,所以可用水的体积代替溶液体积;溶液与水混合时,可忽略体积的变化。因为NaOH溶解时会放出大量的热,在量筒中直接溶解可能会使量筒炸裂;在容量瓶中直接溶解不仅会容量瓶体积发生变化,也可能使容量瓶破裂。
答案 AD
[例2]某学生进行中和实验的过程如下:a.取一支碱式滴定管 b.用蒸馏水洗净 c.即加入待测的 NaOH 溶液 d.记录液面刻度读数 e.用酸式滴定管精确放出一定量标准酸液 f.置于未经标准酸液润洗的锥形瓶中 g.加入适量蒸馏水 h.加入酚酞试液 2 滴 i.滴定时边滴边振荡 j.边注视滴定管内液面的变化 k.当小心滴到溶液由无色变成粉红色时,即停止滴定 l.记录液面刻度读数 m.根据滴定管的两次读数,得出 NaOH 溶液的体积为 22mL。指出上述实验过程中的错误之处(用编号表示) 。
解析 定量实验的操作必须不产生误差或使实验误差尽可能地减小。c 应用待测 NaOH 溶液润洗滴定管后,再装液体。j 滴定时应注视锥形瓶内液体颜色的变化及滴定的速度。k 滴定终点应是溶液变粉红色且半分钟内不褪色。m 体积的读数应读到小数点后面两位,如22.00mL。
答案 c j k m
[例3](06年上海化学26)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如下图装置。倾斜A使稀硫酸(足量)与固体 M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为V mL(已折算成标准状况)由上述实验事实可知:

(1)①固体M中一定有的物质是_____(填化学式)理由是_____。
②其中一种物质的质量可以确定为____g(用代数式表示)。
(2)B装置的名称是_____。写出B装置中反应的离子方程式_____。
(3)C装置的作用是_____,如果实验中没有B装置,则C装置中产生的现象是__________ 。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_____ 。
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是__________
a.M中有未反应的铁和硫
b.测定气体体积时水准管的水面高于量气管的水面
c.A中留有反应生成的气体
d.气体进入D装置前未用浓硫酸干燥
解析 本题是一道定性和定量相结合的综合实验考题,试题借助Fe和S反应的产物与硫酸发生反应,根据实验现象进行问题设计,综合考查学生的实验探究能力。 因反应后的固体与稀硫酸发生反应产生的气体能使B装置增重,由此推断产生了H2S气体,故M中含有FeS,又因气体通过B和C后还收集到V mL气体,依据试题信息,该气体只能是H2,故M中还含有Fe。Fe的质量为:V/22400×56=V/400g;从整个装置的设计来分析,实验的流程是让混合气体先通过B洗气瓶除去H2S,然后再通过CuSO4溶液检验H2S是否除净,故B装置的名称是洗气瓶,其中反应的离子方程式为:2OH-+H2S→2H2O+S2-;C装置的作用是证明H2S 已被完全吸收,如果实验中没有B装置,则C装置中将产生CuS黑色沉淀;稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是S,分离该固体,应采用过滤的操作,所需玻璃仪器为烧杯、漏斗和玻璃棒;测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和的原因为:若A中留有气体,导致D中测量的气体减少,从而影响对剩余铁的计算,若测定气体的体积时水面高于量气管,会导致量气管内气体压强增大,使测量的气体体积变小,导致Fe的计算量变小。
答案 (1)①FeS、Fe B装置增重、量气管有气体。② V/11200
(2)洗气瓶 2OH-+H2S → 2H2O+S2--
(3)证明H2S已被完全吸收 黑色沉淀
(4)硫 漏斗、玻璃棒 (5) b、C。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com