
20.(10分)利用化学原理可以对工厂排放的废水进行有效检测和合理处理。
(1)染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润红色石蕊试纸变蓝的气体)。除去NO2-离子的离子方程式是 。
(2)废水中的N、P元素是造成水体富营养化的主要因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过两种方法将其除去。
①方法一:将Ca(OH)2或CaO投加到待处理的废水中,生成磷酸钙,从而进行回收。当处理后的废水中c(Ca2+)=2×10-7mol/L时,溶液中c(PO43-)=
(已知常温时,KSP[Ca3(PO4)2]=2×10-33)
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石--鸟粪石,反应的方程式为Mg2++ NH4++ PO43-= MgNH4 PO4。该方法中需要控制污水的pH为7.5-10,若pH高于10.7,鸟粪石的产量会大大降低。其原因可能是 。与方法一相比,方法二的优点是 。
(3)三氯乙烯在印刷、纺织等行业应用广泛,为了减少其对环境的影响,可将三氯乙烯在二氧化钛薄膜上催化降解,其反应的机理如下:
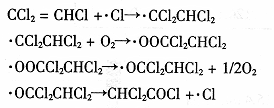
该反应的总化学方程式为 。
19.(8分)空气中微量的臭氧对人有益,浓度过大则是一种污染气体,臭氧作为强氧化剂,几乎能与任何生物组织反应。
(1)下列有关说法正确的是
 。
。
A.停止使用氟里昂是为保护臭氧层
B.光化学烟雾与大气臭氧的生成有关
C.家用电器消毒柜中产生的臭氧能够高效杀菌消毒
D.臭氧能使湿润的碘化钾-淀粉试纸变蓝
( 2)臭氧的化学性质极不稳定,在空气和水中都会慢慢分解成氧气,
臭氧常用于自来水的消毒,臭氧的溶解度及在水中的分解速度与水温及水的pH关系如下图:
2)臭氧的化学性质极不稳定,在空气和水中都会慢慢分解成氧气,
臭氧常用于自来水的消毒,臭氧的溶解度及在水中的分解速度与水温及水的pH关系如下图:
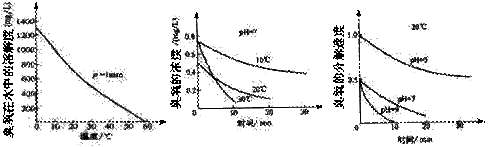
用臭氧消毒自来水,适宜的条件是 。
(3)2O3(g) →3O2(g) △H=-285kJ/mol, 2Ag2O(s) = 4Ag(s)+ O2(g)△H=62.2 kJ/mol,臭氧能与银化合为Ag2O,该反应的热化学方程式为: 。
(4)臭氧在有机合成有广泛用途,可将烯烃氧化为醛同时生成氧气,试写出2-丁烯与臭氧反应的化学方程式: 。
18.(14分)现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题.
(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。
主要反应为:2ZnS +3O2 2ZnO+2SO2 ;鼓风炉中:2C
+O2
2ZnO+2SO2 ;鼓风炉中:2C
+O2 2CO
2CO
鼓风炉中:ZnO+CO Zn + CO2
Zn + CO2
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对些研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2
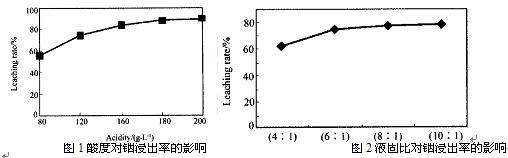
①当酸度为196时,其物质的量浓度为 。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为: 、 。
(2)湿法 炼锌的主要工艺流程为:
炼锌的主要工艺流程为:

 ①硫酸浸取的主要反应的离子方程式为: 。
①硫酸浸取的主要反应的离子方程式为: 。
②从保护环境和充分利用原料角度,如何处理或利用烟气 。
③除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式 。
④酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式 、 。
17.(12分)以黄铜矿(主要成份为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下:
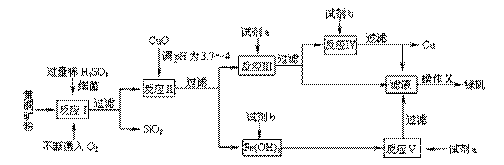
|
已知:① 4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表
|
沉淀物 |
Cu(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
|
开始沉淀pH |
4.7 |
2.7 |
7.6 |
|
完全沉淀pH: |
6.7 |
3.7 |
9.6 |
(1)试剂a是 ,试剂b是 。
(2)操作X应为蒸发浓缩、 、 。
(3)反应Ⅱ中加CuO调pH为3.7-4的目的是 ;
(4)反应Ⅴ的离子方程式为 。
16.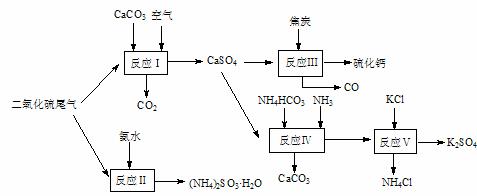 (8分)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:
(8分)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:
(1)已知对苯二酚是一种强还原剂。生产中,反应Ⅱ中往往需要向溶液中加入适量的对苯二酚等物质,其目的是 。
(2)下列有关说法正确的是 。
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C CaS
+4CO↑
CaS
+4CO↑
C.反应Ⅳ需控制在60-70℃,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
(3)反应Ⅴ反应液用40%乙二醇溶液,温度控制在25℃,硫酸钾的产率超过90%,其原因是 。
(4)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,试写出二氧化氮与亚硫酸铵反应的化学方程式 。
15.(14分)制取碘盐的流程如下:
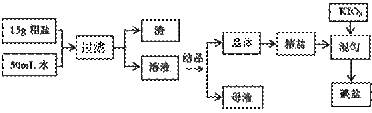
试回答下列问题
(1)检验母液中是否含有SO42-离子的方法是 。
(2)过滤时,用到的玻璃仪器有: 、 、 。
 (3)国家标准
(3)国家标准 GB546061-92规定碘盐含碘量(以碘计),出厂产品≥40mg/Kg。销售品≥30mg/Kg。某次实验时向一干净的坩埚中放入5g精盐,加入1mL0.
GB546061-92规定碘盐含碘量(以碘计),出厂产品≥40mg/Kg。销售品≥30mg/Kg。某次实验时向一干净的坩埚中放入5g精盐,加入1mL0. 001mol/L标准KIO3溶液搅拌均匀,在100℃恒温烘干1h,即得碘盐产品,该碘盐的含碘量约为: mg/Kg(保留一位小数),是否是合格产品 (填:合格、不合格)。
001mol/L标准KIO3溶液搅拌均匀,在100℃恒温烘干1h,即得碘盐产品,该碘盐的含碘量约为: mg/Kg(保留一位小数),是否是合格产品 (填:合格、不合格)。
(4)检验碘盐是否加有碘酸钾,定性检验方法是在酸性介质中加还原剂KCNS,其反应如下:6IO3-+5CNS-+H++2H2O=3I 2+5HCN+5SO42-,检验时,除需用KCNS外,还需要的一种试剂,最好是
。
2+5HCN+5SO42-,检验时,除需用KCNS外,还需要的一种试剂,最好是
。
(5)碘盐中的碘酸钾在560℃开始分解产生无色气体,剩余固体加硝酸酸化的硝酸银有黄色沉淀,碘盐在热水中,也会生成两种单质,其中一种是无色气体,滴加酚酞显红色,请写出碘酸钾两种情况下分解的化学方程式: 或 。
14.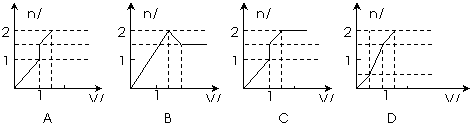 向含1mo
向含1mo l HCl和1mol MgSO4的混合溶液中加入1mol·L-1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是 ( )
l HCl和1mol MgSO4的混合溶液中加入1mol·L-1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是 ( )
非选择题(共78分)
13. 右图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片。观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面。以下有关解释合理的是
右图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片。观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面。以下有关解释合理的是  ( )
( )
A.生铁片中的碳是原电池的负极,发生还原反应
B.雨水酸性较强,生铁片仅发生析氢腐蚀
C.墨水回升时,碳极反应式为:O2 + 2H2O + 4e- == 4OH-
D.具支试管中溶液pH逐渐减小
12.下列有关叙述:① 非金属单质N能从M的化合物中置换出非金属单质M;② M原子比N原子容易得到电子;③两元素的阴离子在电极上放电时,N-优先于M-;④气态氢化物水溶液的酸性HmM>HnN;⑤氧化物水化物的酸性HmMOx>HnNOy;⑥单质熔点M>N。能说明非金属元素M比N的非金属性强的是 ( )
A.②⑤ B.②③ C.①②③ D.①②③⑤
11.为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
( )
|
|
被提纯的物质 |
除杂试剂 |
分离方法 |
|
A |
溴化钠溶液(NaI) |
氯水、CCl4 |
萃取、分液 |
|
B |
CO(CO2) |
饱和NaHCO3溶液 |
洗气 |
|
C
|
FeSO4(Fe2(SO4)3)) |
足量铁屑 |
过滤 |
|
D |
CO2(SO2) |
品红 |
洗气 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com