
2.已知函数 y=sin(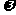 x+
x+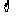 )与直线y=
)与直线y=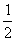 的交点中距离最近的两点距离为
的交点中距离最近的两点距离为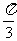 ,那么此函数的周期是
,那么此函数的周期是
A 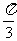 B
B 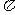 C 2
C 2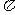 D 4
D 4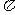
1.在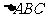 中,
中,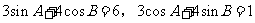 ,则
,则 的大小为
的大小为
A.
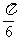 B.
B.
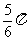 C.
C.
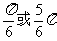 D.
D.
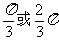
23.(4分).在20℃时一刚性容器内部有一不漏气且可左右滑动的活塞将容器分隔成左、右室两室。左室充入N2,右室充入H 2和O 2的混合气体,此时活塞正好停留离左端1/4处(如右图a)然后用电火花引燃右室气体,反应完毕恢复至原来温度,活塞恰好停留在容器中间(如右图b),水蒸气的体积可忽略,则反应前充入右室的混合气体中H 2和O 2的体积比为?
22.(4分) 在干燥烧瓶中用向上排空气法收集氯化氢,由于空气不可能排净,所以瓶内气体对氢气的相对密度为17,将此瓶气体倒置于水槽中(氯化氢极易溶于水),烧瓶内液面上升的体积占烧瓶总体积的 (填分数) ,假设溶质不向烧瓶外扩散,则所得盐酸中氯化氢的物质的量浓度为 mol/L(假设在标准状况下)
21.(6分)某状况下,2g 二氧化碳气体的体积是 1120 mL,2g A 气体的体积是 770 mL,A的摩尔质量是__________。 某金属氯化物 MCl2 40.5 g 含 0.6 mol Cl-,则该氯化物的摩尔质量为__________,金属M的相对原子质量为__________。
20.(8分)科学研究表明,由于大量使用氟利昂使南极上空的臭氧层出现空洞。臭氧的化学式为O3。在同温同压下,相同质量的O2和O3的物质的量比为 ,体积比为 ,氧原子数比为 ,密度比为
19.(10分)现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为 mol。
(2)该气体所含原子总数为 个。
(3)该气体在标准状况下的体积为 L。
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为 。
(5)该气体溶于水后形成VL溶液,其溶质的物质的量浓度为 mol·L-1。
18.(17分)实验室需要0.1 mol/L NaOH溶液450 mL,需要0.5 mol/L硫酸溶液500 mL.根据这两种溶液的配制情况回答下列问题:
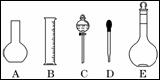
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称).
(2)根据计算用托盘天平称取NaOH的质量为 g.
(3)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为
mL(计算结果保留一位小数).如果实验室有15 mL、20 mL、50 mL量筒,应选用 mL的量筒最好.配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 。
(4)取用任意体积的所配0.5 mol/L硫酸溶液时,下列物理量中不随所取体积的多少而变化的是(填字母)
A.溶液中H2SO4的物质的量 B.溶液的浓度
C.溶液中SO42-的数目 D.溶液的密度
(5)将所配制的稀H2SO4进行测定,发现浓度大于0.5mol/L。请你分析下列哪些操作会引起所配浓度偏大(填写字母) 。
A.烧杯未进行洗涤
B.配制前,容量瓶中有少量蒸馏水
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容;
D.往容量瓶转移时,有少量液体溅出
E.用量筒量取浓硫酸时,仰视量筒的刻度
F.在容量瓶中定容时俯视容量瓶刻度线
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
17.有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl 离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)为(
)mol·L-1 ( )
离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)为(
)mol·L-1 ( )
A.(y-2x)/a B.(y-x)/a
C.(2y-2x)/a D.(2y-4x)/a
16.用单位质量的溶剂中所含溶质的物质的量来表示的溶液浓度叫做质量物质的量浓度,其单位为mol/kg,若5 mol/kg的H2SO4溶液的密度为1.30 g/mL,则它的物质的量浓度为
( )
A.3.56 mol/L B.4.36 mol/L
C.5.00 mol/L D.5.25 mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com