
1.阿伏加德罗定律:
在同温同压下,同体积的气体含有相同的分子数。即:T1=T2;P1=P2
;V1=V2  n1 = n2
n1 = n2
5.数学表达式:气体的摩尔体积= , 即
, 即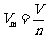
[例2](2009·广州七区联考)下列有关气体体积的叙述中,正确的是( )
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子的大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
C.不同的气体若体积不同,则它们所含的分子数也不同
D.气体摩尔体积是指1mol任何气体所占的体积约为22.4L
[解析]决定物质体积的因素有:①微粒数的多少②微粒本身的大小③微粒间的距离,其中微粒数的多少是决定物质体积大小的主要因素。对于气体物质,在一定温度和压强下,其体积的大小主要由分子数的多少来决定,故A不正确,B正确;气体的体积随温度和压强的变化而变化。体积不同的气体,在不同的条件下,其分子数可能相同,也可能不同,是无法确定的,故C不正确;气体摩尔体积是指1mol任何气体所占的体积,其大小是不确定的,会随着温度、压强的变化而变化,22.4L/mol是标准状况下的气体摩尔体积,故D不正确。
[答案]B
|
特别提醒: 气体摩尔体积的一个特例就是标准状况下的气体摩尔体积(V0)。在标准状况下,1mol任何气体的体积都约等于22.4 L。在理解标准状况下的气体摩尔体积时,不能简单地认为“22.4 L就是气体摩尔体积”,因为这个22.4 L是有特定条件的。这些条件就是: ①标准状况,即0℃和101.325 kPa,气体的物质的量为1 mol,只有符合这些条件的气体的体积才约是22.4 L。因此,22.4 L是1 mol任何气体在标准状况下的体积。 ②这里所说的标准状况指的是气体本身所处的状况,而不指其他外界条件的状况。例如,“1 mol H2O(g)在标准状况下的体积为22.4 L”是不正确的,因为在标准状况下,我们是无法得到气态水的。 ③1mol任何气体的体积若为22.4 L,它所处的状况不一定就是标准状况。根据温度、压强对气体分子间平均距离的影响规律知,温度升高一倍或压强降低一半,分子间距将增大一倍;温度降低一半或压强增大一倍,分子间距将减小一半。由此可知,1 mol任何气体在0℃ 、101 kPa条件下的体积与273℃ 、202kPa条件下的体积应相等,都约为22.4L。 |
考点三 阿伏加德罗定律及其推论
4.标准状况下,气体摩尔体积约为22.4L/mol
3.单位:L/mol(或L·mol-1)
2.表示符号:Vm
1.定义:单位物质的量的气体所占的体积,叫做气体摩尔体积。
3.关系式:n =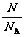 ;n =
;n =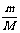
[例1]下列关于物质的量的叙述中,正确的是( )
A.1mol食盐含有6.02×1023个分子 B.Mg的摩尔质量为24
C.1mol水中含有2mol氢和1mol氧 D.1molNe含有6.02×1024个电子
[解析] NaCl为离子化合物,其结构中无分子,且食盐为宏观物质,不可用mol来描述,故A不正确;Mg的摩尔质量为24g/mol,单位不对,故B不正确;C中对1mol水的组成的描述不正确,应为:1mol水中含有2mol氢原子和1mol氧原子;故答案为D。
[答案]D
|
特别提醒: 1.摩尔只能描述原子、分子、离子、质子、中子和电子等肉眼看不到、无法直接称量的化学微粒,不能描述宏观物质。如1mol麦粒、1mol电荷、1mol元素的描述都是错误的。 2.使用摩尔作单位时,应该用化学式(符号)指明粒子的种类。 如1mol水(不正确)和1molH2O(正确);1mol食盐(不正确)和1molNaCl(正确) 3.语言过于绝对。如6.02×1023mol-1就是阿伏加德罗常数;摩尔质量等于相对原子质量、相对分子质量;1摩尔任何物质均含有阿伏加德罗常数个粒子等。 |
考点二 气体摩尔体积
2.摩尔质量(M)
1摩尔物质的质量,就是该物质的摩尔质量,单位是g/mol 。1mol任何物质均含有阿伏加德罗常数个粒子,但由于不同粒子的质量不同,因此,1 mol不同物质的质量也不同;12C的相对原子质量为12,而12 g 12C所含的碳原子为阿伏加德罗常数,即1 mol 12C的质量为12g。同理可推出1 mol其他物质的质量。
1.物质的量
(1)物质的量是七个基本物理量之一,其意义是表示含有一定量数目的粒子的集体。符号为:n ,单位为:摩尔(mol)。
(2)物质的量的基准(NA):以0.012kg12C所含的碳原子数即阿伏加德罗常数作为物质的量的基准。阿伏加德罗常数可以表示为NA,其近似值为6.02×1023 mol-1
6.用电子式表示化合物的形成过程。如HCl的形成过程:
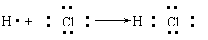
[例3] (2008·山东)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)冶炼铜的反应为: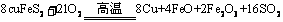 ;若CuFeS2中Fe的化合价为+2,反应中被还原的元素是___________(填元素符号)。
;若CuFeS2中Fe的化合价为+2,反应中被还原的元素是___________(填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是________(填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2 :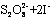
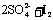
通过改变反应途径Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。____ ____、
______ _____(不必配平)
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、AI2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
据以上信息回答下列问题:
a.除去Al3+的离子方程式是_________ _____。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为_____________。
证明炉渣中含有FeO的实验现象为______ _____。
[解析](1)由氧化还原反应概念易知,反应中Cu、O的化合价降低,被还原。(2)从能够吸收SO2和变废为宝的角度出发可用b、c来回收。(3)Fe3+有氧化性,可氧化I-,而改变反应途径;Fe2+有还原性,可被K2S2O8氧化而改变反应途径。(4)Al(OH)3能溶于NaOH溶液,而Fe(OH)3不溶,可加入过量的NaOH溶液除去Al(OH)3 ;利用Fe2+的还原性,能使酸性KMnO4溶液褪色,可用稀硫酸、KMnO4溶液来验证炉渣中含有FeO。
[答案](1)Cu、O (2)b、c
(3)2Fe3++2I- 2Fe2++I2 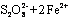
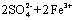
(4)a.Al3+ + 4OH- == AlO2- + 2H2O
b.稀硫酸、KMnO4溶液 ;稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com