
6.常温时,将500 ml pH=5的Cu SO4 溶液用石墨电极电解一段时间,测得溶液的pH变为2,若使溶液的浓度、pH与电解前相同,可采用的方法( )。
A.向溶液中加入0.245g Cu (OH)2 B.向溶液中加0.31g CuSO4
C.向溶液中加0.0025 mol H2 SO4并加热 D.向溶液中加0.2g CuO
5.在25ºC时,将两根铂电极插入一定量的硫酸钠饱和溶液中进行电解,当电路中有a mol电子转移时,溶液中析出mg Na2SO4 ·10 H2 O晶体。若温度不变,在剩余溶液中溶质的质量分数为( )。
A.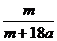 ×100% B.
×100% B.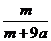 ×100% C.
×100% C.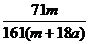 ×100% D.
×100% D.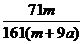 ×100%
×100%
4.下列叙述能说明金属甲比金属乙活泼的实际事实是( )。
A.同价态的阳离子,甲的氧化性比乙强
B.将甲、乙作电极与稀硫酸酸溶液组成原电池,甲是负极
C.在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多
D.常温下,甲能和 NaOH溶液反应,而乙不能
3.电解硫酸铜溶液时,若要求达到以下几点:⑴阳极质量减少,⑵阴极质量增加,⑶电解液中[Cu2+]不变,则可选用的电极是( )。
A.纯铜作阳极,含锌、银的铜合金作阴极
B.含锌、银的铜合金作阳极,纯铜作阴极
C.用纯铁作阳极,用纯铜作阴极
D.用石墨作阳极,用惰性电极作阴极
2.下列叙述中不正确的是( )。
A.电解池的阳极上发生氧化反应,阴极上发生还原反应
B.原电池跟电解池连接后,电子从电池负极流向电解池阳极
C.电镀时,电镀池里的阳极材料发生氧化作用
D.电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气
1.如下图所示,铜片和锌片用导线连接后插入番茄里,锌片是( )。

A.阳极 B.正极 C.阴极 D.负极
例9、 用铂电极电解盐R(NO3)n溶液,在阴极上析出m g R,在阳极上放出560 mL气体(标准状况),则R的相对原子质量是
A.mn/10 B.10m/n C.20mn D.10mn
分析 : 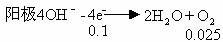
阴极Rn++ne-=R n∶R=0.l∶m R=10mn答案为D。
例10、工业处理含Cr2O72-酸性工业废水用以下方法:
①向工业废水中加入适量NaCl;
②用Fe电极进行电解,一段时间后有Cr(OH)3和Fe(OH)3沉淀生成;
③过滤回收沉淀,废水达排放标准。
(1)电解时电极反应:阳极_________________,阴极________________。
(2)加入NaCl的目的是____________________________。
(3)写出Cr2O72-转变成Cr3+的离子方程式_________________________________。
(4)电解过程中Cr(OH)3和Fe(OH)3沉淀是怎样生成的_________________。
(5)能否用石墨来代替Fe电极______。
解析: 问题的关键在于阴、阳两极上的反应。事实上,由于阳极为Fe,阳极上只能Fe失电子生成Fe2+,所以正确答案为:
(1)阳极Fe-2e- Fe2+
阴极2H++2e-
Fe2+
阴极2H++2e- H2↑
H2↑
(2)增强溶液的导电能力。
(3)Cr2O72-+6 Fe2++14 H+==2Cr3++6Fe3++7H2O
(4)电解时H+在阴极上不断放电,Fe2+还原Cr2O72-;消耗H+,使溶液中[H+]减小,pH增大,生成Fe(OH)3、Cr(OH)3沉淀。
(5)不能。若用石墨电极,不能提供还原剂Fe2+,无法使Cr2O72-还原而除去。
知能训练
例7、 用阳极a和阴极b电解c的水溶液,然后加入d,能使溶液恢复到电解前状态,a、b、c、d正确组合是
A.Pt P t NaOH NaOH B.C C NaCl NaOH
C.Cu Cu CuSO4 Cu(OH)2 D.Pt Pt H2SO4 H2O
解析: 根据阴阳两极析出什么应加入相对应的它们组成物质。正确答案为D。
例8、 当用两铂电极电解100 g 10%CuSO4溶液一段时间后,在阳极析出0.16g物质时,CuSO4溶液的质量分数为
A.8.47% B.8.36% C.8.73% D.9.62%
解析: 据CuSO4电解的方程式2CuSO4+2H2O 2Cu+O2↑+2H2SO4阳极上析出O2。电解后溶液中CuSO4的质量为:
2Cu+O2↑+2H2SO4阳极上析出O2。电解后溶液中CuSO4的质量为: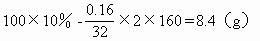
溶液的质量变为: 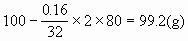
所以 w(CuSO4)=8.47%
答案为A。如果题目改为阴极析出0.16g物质,则答案为D。
例3、右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板有无色无臭气体放出,符合a极板 b极板 x电极 z溶液的是
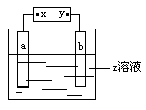
A.锌 石墨 负极 CuSO4 B.石墨 石墨 负极 NaOH
C.银 铁 正极 AgNO3 D.铜 石墨 负极 CuCl2
解析:a极质量增加,a为阴极,即x极为负极,且电解液需有不活泼金属的阳离子,所以只能从A、D中选。再b极板上有无色无臭气体放出,D不符合(放出Cl2),所以只有A正确。
例4、将0.4 mol CuSO4和0.4 molNaCl配成水溶液1L,用惰性电极电解一段时间,在一个电极上得到0.3 mol Cu,另一极上生成标准状况下气体体积为
A.5.6 L B.6.72 L C.1.344 L D.11.2 L
解析: 阴极Cu2++2e- Cu 0.3 mol
Cu-0.6 mol e-
Cu 0.3 mol
Cu-0.6 mol e-
阳极 2Cl-- 2e-  Cl2↑ 0.4 mol Cl-- 0.4 mol e-- 0.2 mol
Cl2
Cl2↑ 0.4 mol Cl-- 0.4 mol e-- 0.2 mol
Cl2
4OH--4 e- 2H2O+O2↑ 0.2 mol e--0.05 mol O2
2H2O+O2↑ 0.2 mol e--0.05 mol O2
因而得到了0.25 mol Cl2和O2的混合气体,所以正确答案为A。
例1、 下列装置线路接通后,经过一段时间后溶液的pH明显下降的是
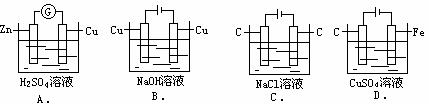
解析:
A是原电池,负极为Zn-2e Zn2+,正极为2H++2e-
Zn2+,正极为2H++2e- H2↑,总的反应为: Zn+2H+== Zn2++H2↑,溶液中[H+]不断减小,pH升高。
H2↑,总的反应为: Zn+2H+== Zn2++H2↑,溶液中[H+]不断减小,pH升高。
B为电解池,且阳极为非惰性电极铜,阳极反应为Cu-2e Cu2+,Cu2++2OH-=Cu(OH)2↓,阴极为2H++2e-
Cu2+,Cu2++2OH-=Cu(OH)2↓,阴极为2H++2e- H2↑,总的反应为:Cu+2H2O=Cu(OH)2↓+H2↑溶液实际上少了H2O,造成NaOH浓度增大,pH升高。
H2↑,总的反应为:Cu+2H2O=Cu(OH)2↓+H2↑溶液实际上少了H2O,造成NaOH浓度增大,pH升高。
C电解反应式为:2Cl-+2H2O Cl2↑+H2↑+2OH- ,pH升高。
Cl2↑+H2↑+2OH- ,pH升高。
D电解反应式为:2Cu2++2H2O 2Cu+O2↑+4H+pH变小。答案为D。
2Cu+O2↑+4H+pH变小。答案为D。
例2、 以A、B两根石墨棒作电极,电解AgNO3溶液,通电t min,在B极收集到气体11.2mL(标准状况),然后将电源反接,以相同的电流通电t/2min,若溶液体积为200mL(设体积不变),则溶液的pH为______。
解析: 通电tmin,电解AgNO3溶液:4Ag++2H2O 4Ag+O2↑+4 H+
4Ag+O2↑+4 H+
再通电t/2min,是电镀,溶液中各离子浓度不再改变。pH=2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com