
2、多元弱碱(多元弱碱盐)的电离(水解)书写原则:一步书写
例:Al3+ + 3H2O  Al(OH)3
+ 3H+
Al(OH)3
+ 3H+
1、多元弱酸(多元弱酸盐)的电离(水解)的书写原则:分步书写
例:H2S的电离H2S  H+ + HS-
; HS-
H+ + HS-
; HS-  H+ + S2-
H+ + S2-
例:Na2S的水解:H2O+ S2-
 HS- +
OH-
H2O + HS-
HS- +
OH-
H2O + HS-  H2S
+ OH-
注意:不管是水解还是电离,都决定于第一步,第二步一般相当微弱。
H2S
+ OH-
注意:不管是水解还是电离,都决定于第一步,第二步一般相当微弱。
6、盐类水解的应用:
①混施化肥(N、P、K三元素不能变成↑和↓)②泡沫灭火剂(用硫酸铝和小苏打为原料,双水解)③FeCl3溶液止血剂(血浆为胶体,电解质溶液使胶体凝聚)④明矾净水(Al3+水解成氢氧化铝胶体,胶体具有很大的表面积,吸附水中悬浮物而聚沉)⑤NH4Cl焊接金属(氯化铵呈酸性,能溶解铁锈)⑥判断溶液酸碱性(强者显性)⑦比较盐溶液离子浓度的大小 ⑧判断离子共存(双水解的离子产生沉淀和气体的不能大量共存)⑨配制盐溶液(加对应的酸防止水解)
5、双水解反应:
(1)构成盐的阴阳离子均能发生水解的反应为双水解反应(即弱酸弱碱盐)。双水解反应相互促进,水解程度较大,有的甚至水解完全。其促进过程以NH4Ac为例解释如下:
NH4Ac == NH4+ + Ac- NH4+ + H2O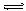 NH3·H2O + H+ Ac- +
H2O
NH3·H2O + H+ Ac- +
H2O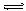 HAc + OH-
HAc + OH-
两个水解反应生成的H+和OH-反应生成水而使两个水解反应的生成物浓度均减少,平衡均右移。
(2)常见的双水解反应完全的为:Fe3+、Al3+与AlO2-、CO32-(HCO3-)、S2-(HS-)、SO32-(HSO3-);其特点是相互水解成沉淀或气体。双水解完全的方程式写“==”并标“↑↓”,其离子方程式配平依据是两边电荷平衡,如:2Al3+ + 3S2- + 6H2O == 2Al(OH)3↓+ 3H2S↑
4、酸式盐溶液的酸碱性:①只电离不水解:如HSO4- ②电离程度>水解程度,显酸性 (如: HSO3- 、H2PO4-) ③水解程度>电离程度,显碱性 (如:HCO3- 、HS- 、HPO42-)。
3、影响盐类水解的外界因素:①温度:温度越高水解程度越大 (水解吸热)②浓度:浓度越小,水解程度越大(越稀越水解)③酸碱:促进或抑制盐的水解(H+促进阴离子水解而抑制阳离子水解;OH-促进阳离子水解而抑制阴离子水解)
2、盐类水解的特点:(1)可逆 (2)程度小 (3)吸热
1、盐类水解规律:
①有弱才水解,无弱不水解,越弱越水解;谁强显谁性,两弱相促进,两强不水解。②多元弱酸根,浓度相同时正酸根比酸式酸水解程度大,碱性更强。 (如:Na2CO3 >NaHCO3)③弱酸酸性强弱比较:
A、同主族元素最高价含氧酸的酸性递减,无氧酸的酸性递增(利用特殊值进行记忆。如酸性:
HF<HCl;HNO3>H3PO4)
B、饱和一元脂肪酸的碳原子数越小,酸性越强(如HCOOH>CH3COOH)
C、一些常见的酸的酸性:HClO、HAlO2、苯酚为极弱酸;醋酸>碳酸;磷酸和H2SO3为中强酸;
HClO4为最强含氧酸等。
2、自由H+与OH-恰好中和(现金相等),即“14规则:pH之和为14的两溶液等体积混合,谁弱显谁性,无弱显中性。”
1、酸、碱恰好反应:恰好生成盐和水,看盐的水解判断溶液酸碱性。(无水解,呈中性)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com