
3.下列物质中,可用于治疗胃酸过多的是
A.碳酸钠 B.氢氧化铝 C. 氧化钙 D.碳酸钙
2.国际上推广使用中国铁锅,这是因为铁锅
A.是单质 B.含碳,属混合物 C.化学性质活泼D.易使食物中含人体所需的铁元素
1. 下列所用材料不属于合金的是
A.家用的铝窗 B.建筑用的钢筋
C.铸造用的黄铜 D.温度计用的水银
Fe、Fe2+、Fe3+之间的相互转化关系,可用如下大铁三角关系图说明。

考题回顾
[例1](2002年全国高考19题)如图所示已知:①甲、乙、丙、丁均为前三周期元素的单质。②在一定条件下甲与丙和甲与丁都按物质的量之比1:3反应,分别生成X和Y,在产物中元素甲呈负价。③在一定条件下乙与丙和乙与丁都按物质的量之比1:2反应,分别生成Z和W,在产物中元素乙呈负价。请填空:
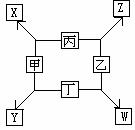
(1)甲是__________,乙是__________。
(2)甲与丙反应生成X的化学方程式是__________。
(3)乙与丁反应生成W的化学方程式是__________。
解析:(1)由②得知,甲必为短周期中的负三价元素N或P,又由常见反应知甲只能为N。由③得知,乙必为短周期负二价元素,只有0符合。(乙为S时,分别与丙、丁反应比不为1:2)(2)丙、丁也可互换。均符合题意。1)当丙为Mg时,丁为H2。2)当丙为H2时,则丁为Mg。
答案:(1)甲是N2,乙是O2。(2)N2+ +3Mg Mg3N2(或N2+3H2
Mg3N2(或N2+3H2 2NH3);(3)O2+2H2=2H2O(或2Mg+O2=2MgO)。
2NH3);(3)O2+2H2=2H2O(或2Mg+O2=2MgO)。
[例2](2001广东高考试题)将等物质的量的两种氧化物溶于100mL硫酸,而后逐滴加入1.00mol/L的氢氧化钠溶液.当加入的氢氧化钠的体积V1=50mL时,开始有沉淀析出,且沉淀量随氢氧化钠的加入量逐渐增加.当氢氧化钠的体积V2=650mL时,沉淀量达到最大值,继续滴加氢氧化钠时,沉淀量逐渐减小.当 时,沉淀量不再改变.
时,沉淀量不再改变.
(1)最初加入的50mL氢氧化钠溶液的作用是什么?
(2)计算所用硫酸的浓度.
(3)试判断两种氧化物各是什么,并计算其物质的量.
分析:本题考察的知识点是物质的量在化学反应中的应用及两性氧化物的性质等基础化学知识和简单的推理计算能力和思维的整体性.从题目中可以得知这两种化合物都为金属氧化物,溶于酸后加入氢氧化钠50mL才开始有沉淀析出,证明硫酸是过量的.这部分氢氧化钠是来中和过量的硫酸的。当又滴入600mL氢氧化钠时金属离子完全沉淀,再加入100mL氢氧化钠时有一种金属氢氧化物沉淀恰好被溶解完,可判断该氢氧化物为氢氧化铝且物质的量为0.1mol,则氧化铝为0.05mol.所以另一种氧化物也为0.05mol,溶于酸后产生的金属离子完全沉淀时也消耗0.3mol的氢氧化钠.由此可以推出其化合价为+3价,必为三氧化二铁。
解答:
(1)中和过量的硫酸
(2)沉淀量最大时所用OH-的物质的量与100mL强酸中H+的物质的量相等, n(OH-)=1.00mol/L×0.650L=0.650mol,故n(H+)也为0.650mol,故n(H+)也为0.650mol,硫酸的浓度为3.25mol/L。
(3)由题意知,其中一种氧化物为Al2O3,根据Al(OH)3+OH=AlO2-+2H2,该反应用去的n(NaOH)=1.00mol/L×(0.750-0.650)L=0.100mol故Al(OH)3为0.100mol,而Al2O3为0.0500mol根据Al3++3OH-=Al(OH)3,生成Al(OH)3用去0.300molNaOH。而生成另一种氢氧化物也用去0.300molNaOH,且已知两种氧化物的物质的量相等,故另一种氧化物也是三价金属的氧化物,且不溶于过量碱溶液中,可知其为Fe2O3。Fe2O3的物质的量为0.0500mol
点悟:本题的易错点是将50mL氢氧化钠中和的硫酸当作100mL硫酸中的全部硫酸,求出了硫酸的浓度为0.5mol/L.根据氧化物不溶于氢氧化钠认为是氧化镁或氧化铁的确定缺乏说服力,没有任何说明直接得出结论.在作题目时要言之有据.
[例3] (2004年全国理综Ⅲ,26)粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:①取适量A进行铝热反应,产物中有单质B生成;②另取20 g A全部溶于0.15L6.0 mol· 盐酸中,得溶液C;③将①中得到的单质B和溶液C反应,放出 l.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;④用KSCN溶液检验时,溶液D不变色。
盐酸中,得溶液C;③将①中得到的单质B和溶液C反应,放出 l.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是 ,产物中的单质B是 。
(2)②中所发生的各反应的化学方程式是 。
(3)③中所发生的各反应的离子方程式是 。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为__________, c(Fe2+)为__________。
[巧解思路]设试样A中MgO、Fe2O3的物质的量依次为x、y。由题意有如下变化关系:

因为所加HCl中的氢原子全部进入H2O和H2中,所以,据氢元素守恒有:
n(H2O)=[ n(HCl)-2n (H2)]=0.4mol;
而水分子中的氧原子全部来自两种金属氧化物中,所以,据氧元素守恒有:
n(H2O)= n(MgO)+3n (Fe2O3),即0.4mol=x+3x,解得x=0.1mol;
又因为HCl中的氯原子最终全部进入溶液D的MgCl2和FeCl2中,所以,根据氯元素守恒有:
n(HCl)=2n(MgCl2) +2n(FeCl2),即0.9mol=2×0.1mol+2y,解得y=0.35mol.
因此, D溶液中c(Mg2+)==0.67mol·L-1;c(Fe2+)==2.3mol·L-1。
[例4](2003年广东高考题)取一定量的Na2CO3、NaHCO3和Na2SO4固体的混合物与250mL1.00mol·L-1过量盐酸反应,生成2.016L CO2(标准状况),然后加入500mL0.100mol·L-1Ba(OH)2溶液,得到沉淀的质量为2.33 g,溶液中过量的碱用10.0mL1.00mol·L-1盐酸恰好完全中和。计算混合物中各物质的质量。
[巧解思路]本题涉及的反应方程式有四个:Na2CO3+2HCl==2NaCl+H2O+CO2↑;NaHCO3+HCl==NaCl+H2O+CO2↑;SO42-+Ba2+==BaSO4↓;H++OH-==H2O。按常规思路需分步进行计算,非常繁琐。而运用元素守恒关系则可不必写方程式而快速作答:
设 Na2CO3、NaHCO3和Na2SO4的物质的量分别为x、y、z。
题中2.33g 沉淀应该为BaSO4(物质的量为0.01mol),而反应中加入的Ba(OH)2为0.5L×0.100mol/L=0.05mol,所以,Ba2+有剩余(过量0.05mol-0.01mol=0.04mol),SO42-反应完全,因此,原来SO42-物质的量为0.01mol,即z=0.01mol,Na2SO4的质量为1.42g。
据碳元素守恒有 x+y=n(CO2)==0.09mol ……①
因为最后所得溶液中的溶质有NaCl和BaCl2,其中含BaCl20.04mol。
据钠元素守恒可知:n(NaCl)=2n(Na2CO3)+n(NaHCO3)+2n(Na2SO4)=(2x+y+2z)mol
据氯元素守恒又有n(NaCl)+2n(BaCl2)=n(HCl) 即
2x+y+2z+0.04mol×2=0.25L×1.00mol·L-1+0.01L×1.00mol·L-1=0.26mol
整理得 2x+y=0.16 ……②
解①②联立方程组得 x=0.07mol,y=0.02mol
所以,Na2CO3、NaHCO3的质量分别为0.07mol×106g/mol=7.42g、0.02mol×84g/mol=1.68g。
单元过关测试
26、向浓度均为3mol·L-1的HNO3与H2SO4组成的混合溶液10mL中加入1.92g铜,充分反应后若溶液体积仍为10mL。求:(1)产生气体标准状况下的体积是多少升?(2)反应后溶液中各溶质的离子浓度。
25.将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体
在标准状况下的体积为11.2L。请回答:
(1)NO,NO2的体积各为多少升?
(2)待产生的气体全部释放后,向溶液加入VmLamoL/L的NaOH溶液,恰好使溶液中Cu2+
全部转化成沉淀,则原硝酸溶液的浓度为多少?
(3)欲使铜与硝酸反应生成的气体在 溶液中全部转化为NaNO3,至少需要30%
溶液中全部转化为NaNO3,至少需要30%
的双氧水的质量为多少?。
24、(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是: 。(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物。

这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号): → → → 。
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是 ,B瓶溶液的作用是 ,C瓶溶液的作用是 。
(4)装置②中所加固体药品是 ,可验证的产物是 ,确定装置②在整套装置中位置的理由是 。
(5)装置③中所盛溶液是 ,可验证的产物是 。
23、将红热的黑色固体单质甲放入一黄色的溶液乙中,充分反应后,产生由两种气体组成的混合气体A,A在常温下不与空气作用,将A做如下的实验:
(1)推断各物质的化学式:
甲:__________;乙:__________;丙:__________;
A:__________;B:__________; C:__________。
(2)写出甲与乙反应的化学方程式:_____________________________

22.a、b、c、d、e是含有一种相同元素的五种物质,可发生如下转化:

其中: a是单质;b是气体;c、d是氧化物;e是最高价氧化物对应的水化物。
(1)如果a是一种淡黄色粉末固体,试推断这五种物质(用名称表示): a ;b ;c ;d ;e 。
(2)如果a是一种常见气体,试推断这五种物质(用化学式表示): a ;b ;c ;d ;e 。
21.硫酸的性质有:A.高沸点;B.强酸性;C.吸水性;D.脱水性;E.强氧化性。在
下列硫酸的用途或化学反应中,硫酸可能表现上述的一个或者多个性质,试用字母填空:
(1)实验室制取氢气________;(2)实验室干燥氢气________;(3)浓硫酸与金属铜的反应________;(4)实际生产中,浓硫酸可用钢瓶贮运_______;(5)浓硫酸使蔗糖变黑,且有刺激性气味的气体产生________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com