
[甲烷]分子式CH4,分子量16.04。是最简单的有机化合物。在自然界分布很广,是天然气、煤气等的主要成分,无色无味、难溶于水的可燃性气体,和空气组成适当比例时,遇火花会发生爆炸。
甲烷的化学性质稳定,在一般条件下不与其它物质反应,但在适当条件下能发生氧化、卤代、热解等反应。工业上主要用于制造乙炔、或经转化制取氢气、合成氨及有机合成的原料。也用来制备炭黑、一氯甲烷、二氯甲烷、氯仿、四氯化碳等。甲烷可直接用作燃料。工业上主要由天然气获得。实验室中可用无水醋酸钠和碱石灰共热制得。
[乙烷]分子式C2H6,结构简式CH3CH3,分子量30.068无色无味气体,密度是1.357。微溶于水。与空气形成爆炸性混和物,爆炸极限为:3.2-12.5%(体积)。在石化工业中,乙烷主要作为生产乙烯的原料,也可作为燃料。
[丙烷]分子式C3H3,结构简式CH3CH2CH3,分子量:44.094,无色气体。微溶于水。化学性质很稳定,不易发生化学反应。与空气形成爆炸性混和物,爆炸极限2.4-9.5%(体积)。丙烷经裂解可制取乙烯和丙烯等有机合成的原料。也可用作燃料。
[丁烷]分子式C4H10分子量:58.12。有正丁烷和异丁烷两种异构体。
[正丁烷]结构简式CH3CH2CH2CH3。存在于石油气、天然气和催化裂化气中、无色气体。与空气形成爆炸性混和物,爆炸极限1.6-8.5%(体积)。主要用途是经脱氢制取丁二烯。
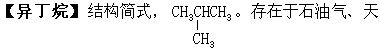
然气及裂化气中。正丁烷经异构化也可生成异丁烷。无色气体。微溶于水,化学性质稳定、与空气形成爆炸性混和物,爆炸极限为1.9-8.4%(体积)。主要用于与异丁烯经烃化制取异辛烷,作为汽油辛烷值的改进剂。也可做冷冻剂。
[戊烷]分子式C5H12分子量:72.146。有正戊烷、异戊烷、新戊烷三种异构体。
[正戊烷]结构简式CH3CH2CH2CH2CH3。无色易燃液体,熔点-129.7℃,沸点36.1℃。不溶于水,微溶于乙醇,溶于烃类和乙醚。
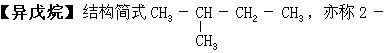
甲基丁烷。无色易燃液体。熔点-159.6℃,沸点是27.9℃。不溶于水,微溶于乙醇,溶于烃类和乙醚。
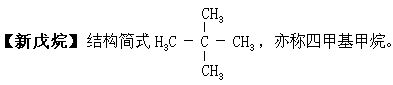
无色气体或易挥发液体。熔点-20℃,沸点9.5℃。不溶于水,溶于乙醇。
戊烷存在于石油和天然气中,是汽油的主要成分。正戊烷在氯化铝和氯化氢存在下经异构化生成异戊烷,异戊烷经脱氢可制异戊二烯,异戊二烯是重要的有机合成原料。
[庚烷]分子式C7H16。分子量:100.2,有九种同分异构体。正庚烷CH3CH2CH2CH2CH2CH2CH3,无色可燃液体,在气缸里燃烧爆炸时震动很剧烈。它的辛烷值假定为零,它和异辛烷(辛烷值假定为100)的混和物常用作测定汽油的辛烷值的标准。
[辛烷]分子式C8H18,分子量,114.22。有十八种同分异构体。其中以异辛烷最重要。
[异辛烷]亦称2.2.4-三甲基戊烷。结构简式:无色易燃液体。在内燃机气缸里燃烧时抗震性较好,是优良的发动机燃料。它的辛烷值假定为100,它与正庚烷(辛烷值假定为零)的混和物常用来作为测定汽油的辛烷值的标准。
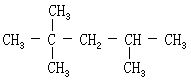
[2,2,3-三甲基丁烷]是庚烷的一种异构体。无色易燃液体,其结构简式:熔点-24.96℃、沸点81.0℃。不溶于水,溶于乙醇。具有极高的抗震性,比许多高辛烷值组分,甚至比异辛烷都好。用作高辛烷值航空燃料的组分。
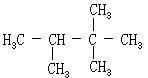
[环丙烷]分子式C3H6,分子量42.08,无色易燃气体,有石油醚的气味。熔点-126.6℃,沸点-33℃。标况下每升重1.879克。在192-588千帕(4-6个大气压)下可液化。稍溶于水,易溶于乙醇、乙醚等有机溶剂。与空气形成爆炸性混和物,爆炸极限为2.4-10.3%(体积)。其性质不稳定,容易变为开链化合物,易为浓硫酸吸收,加氢时开链生成丙烷,与溴反应开链生成1,3-二溴丙烷。环丙烷可用于有机合成,医药上用作麻醉剂。可由1,3-二溴丙烷或1,3-二氯丙烷与钠或锌作用而制得。
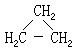
[环丁烷]分子式C4H8,分子量56.10,无色气体,燃烧时有火焰。熔点为-80℃,沸点11℃。液化点-15℃。不溶于水,溶于乙醇、丙酮。用作纤维素醚溶剂。环丁烷的制备可由环丁烯在加热并用镍作催化剂氢化制得,也可用环丁烷羧酸脱羧制得,或者用1.4-二溴丁烷与金属锌在醇溶液中进行反应而制得。
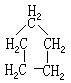
[环戊烷]分子式C5H10,分子量70.13,存在于某些石油裂化副产物的馏分中。无色流动液体,是性质最稳定的环烷烃。熔点-94.4℃,沸点49.3℃。不溶于水,与乙醇、乙醚及其它烃类混溶。可由环戊二烯经氢化制得,或以克里门森法还原环戊酮制得。
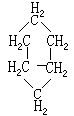
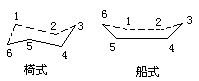
[环己烷]分子式C6H12,分子量84.16,无色流动性液体,有汽油气味。存在于某些石油中。熔点6.47℃,沸点80.7℃,易挥发,易燃烧,其蒸气与空气形成爆炸性混和物,爆炸极限1.3-8.4%,不溶于水,溶于乙醇、乙醚、丙酮、苯、四氯化碳等有机溶剂。环己烷有“椅式”和“船式”两种构象存在(如右图),在涂料工业中广泛地用作溶剂,也是树脂、脂肪、石蜡油类的良好溶剂。更重要的是环己烷经氧化可生成环己醇、环己酮和己二酸等生产尼龙-6或尼龙-66的原料。环己烷可由石油馏分中回收或苯经催化氢化而制得。
[乙烯]分子式C2H4,分子量28.05,是最简单的烯烃。结构简式CH2=CH2,存在于成熟的水果、焦炉煤气及热裂石油气中。是无色带有甜香味的气体。熔点-169.4℃,沸点-103.9℃。临界温度9.6℃,临界压力4968.6千帕(50.7大气压),微溶于水,溶于乙醚、丙酮、苯等。与空气形成爆炸性混和物,爆炸极限为3.02-34%。分子中含有不饱和的碳碳双键,故可与氢气、卤素、卤化氢、水等发生加成反应,也可以在一定条件下发生加聚反应。工业上用于制造乙醇、乙醛、橡胶、塑料、合成纤维、环氧乙烷等。
可由裂化石油气或由乙醇用氧化铝催化脱水制成。
[丙烯]分子式C3H6,分子量42.08,结构简式CH2=CH-CH3。无色气体,带有甜味。熔点-185.2℃,沸点-47.7℃。临界温度91.4-92.3℃,临界压力4410-4468.8千帕(45-45.6大气压)。化学性质活动。与空气形成爆炸性混和物,爆炸极限2.0-11.0%(体积)。分子中含有不饱和的碳碳双键,可与氢气、卤素、卤化氢等发生加成反应,也可发生加聚反应。主要用于制异丙醇、丙酮、合成甘油、合成树脂、合成橡胶、塑料和合成纤维等。
一般由石油热裂化和催化裂化气体中分出,也是轻油裂解制乙烯时的副产物。
[丁烯]分子式C4H8,分子量56.10,有三种异构体,均是无色气体。存在于煤气中,与空气能形成爆炸性混和物。不溶于水,溶于乙醇、乙醚等。
[1-丁烯]结构简式CH3-CH2-CH=CH2。熔点为-185.4℃,沸点-6.4℃。可由热裂石油制得,或用浓硫酸与丁醇反应制得。
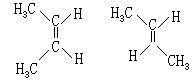
[2-丁烯]结构简式CH3-CH=CH-CH3。无色气体有顺式和反式两种异构体(见结构简式)。顺式:熔点-139.3℃,沸点3.72℃;反式:熔点为:-105.8℃,沸点0.88℃。
[异丁烯]结构简式(CH3)2C=CH2,亦称2-甲基丙烯。无色气体。熔点-139℃,沸点-6.9℃。不溶于水,易溶于乙醇、乙醚等。与空气形成爆炸性混和物,爆炸极限为1.7-9.0%(体积)。
1-丁烯和2-丁烯主要用于经过去氢制得丁二烯。也可以经过水合分别制得正丁醇和仲丁醇。异丁烯加水则生成叔丁醇,若经氧化可生成甲基丙烯醛和甲基丙烯酸,异丁烯还可用于生产丁基橡胶。
[1-戊烯]分子式C5H10,分子量70.13,是戊烯六种异构体中最重要的一种,结构简式CH3CH2CH2CH=CH2。无色可燃性液体,熔点-138℃,沸点30℃。不溶于水,溶于乙醇。高温时裂解为低级烃类。用于有机合成和脱氢制异戊二烯,也可做高辛烷汽油的添加剂。
[1,3-丁二烯]分子式C4H6,分子量54.09,具有共轭双键的最简单二烯烃,结构简式CH2=CH-CH=CH2。无色有特殊气味的气体,有麻醉性。易液化。熔点-108.9℃,沸点-4.45℃。化学性质活泼,易起聚合反应。与空气形成爆炸性混和物,爆炸极限2.16-11.47%(体积)。是制造丁钠橡胶、丁苯橡胶、丁腈橡胶等合成橡胶,合成树脂,合成尼纶等的原料。可由丁烷和丁烯脱氢制得,或由四碳烃馏分分离制得。
[2-甲基-1,3-丁二烯]分子式C5H8,分子量68.11,亦称异戊二烯,结构简式。无色刺激性液体。熔点-120℃,沸点34℃。不溶于水,溶于苯,易溶于乙醇和乙醚。分子中含有共轭双键,容易发生聚合反应。在贮藏过程中易发生氧化和聚合,常加入少量稳定剂如对苯二酚等。主要用于制取丁苯橡胶和顺式聚异戊二烯橡胶。可由高温热裂石油气制得,或由异戊烷和异戊烯脱氢制得,也可由乙炔和丙酮缩合制取。
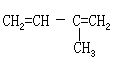
[丙二烯]分子式C3H4,分子量40.07,结构简式H2C=C=CH2。最简单的含聚集双键的烃。两端的氢原子位于相互垂直的两个平面内。不稳定,加热时发生重排形成丙炔,是活性中间体。熔点-146℃,沸点-32℃,通常情况下是无色气体。可用来制备环丁烷及环辛烷的衍生物,可由1.2-二氯内烯在锌粉作用下制得。
[环戊烯]分子式C5H8,分子量68.11,无色液体。熔点-135℃,沸点45-46℃。能开环聚合,也能与共轭二烯烃共聚。可作为共聚单体,也可用于有机合成,存在于石油裂解气碳五馏分中。
可由环戊二烯选择氢化制得,也可由环戊醇脱水而制得。
[环戊二烯]亦称茂。分子式C5H6,分子量66.10,结构简式无色液体。熔点-85℃,沸点41-42℃,不溶于水,溶于乙醇、乙醚、苯、四氯化碳等有机溶剂。性质很活泼,在常温下即聚合成二聚环戊二烯,受热后又解聚仍变为环戊二烯。用于制环戊二烯系农药,还可用来制备某些金属衍生物,如二茂铁及锂、钠、钾、镁等金属衍生物,并作为合成树脂及塑料的原料。可由高温煤焦油苯馏分的前一馏分和轻油裂解制乙烯的副产物碳五馏分中分出。也可由环戊烷的蒸气经催化脱氢而制得。
[环己烯]分子式C6H10,分子量82.14。无色液体。熔点为-103.5℃,沸点83℃。不溶于水,溶于乙醇、乙醚等。存在于煤焦油内。能发生加成反应。可用作溶剂和烷基化试剂。也可用于制备己二酸及用作高辛烷值汽油的稳定剂。可由环已醇在高温和催化剂存在时脱水制得。
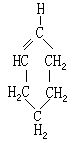
[乙炔]分子式C2H2,分子量26.04,结构简式HC≡CH。俗称电石气。纯净的乙炔是无色无味气体,通常因含有磷化氢而有特殊的刺激性气味。乙炔是最简单的炔烃。熔点-81.8℃,升华点-83.6℃。气体的密度1.173克/升液体的密度0.6181克/厘米3。稍溶于水,溶于乙醇、乙酸、乙醚、苯、丙酮、与空气形成爆炸性混和物,爆炸极限为3-65%(体积)。
乙炔分子中含有碳碳叁键,其中含有一个σ键和两个π键。C≡C健长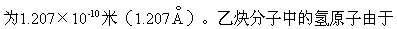
受到C≡C的影响而呈弱酸性,可与强碱反应生成金属化合物,如与氨基钠反应生成炔化钠。化学性质很活动,容易发生加成反应和聚合反应。如在汞盐存在时与水反应生成乙醛;在汞盐存在时与稀盐酸反应生成氯乙烯;在盐酸中有氯化亚铜存在时,与氰化氢反应生成丙烯腈。能与铜和银形成不溶性爆炸混和物。在氧气中燃烧(氧炔焰)可产生高温和强光,用于金属的焊接或切割,并用于夜航标帜灯和一般灯。主要用于制造聚氯乙烯、氯丁橡胶、醋酸、乙酸乙酯等。可由碳化钙(电石)与水反应制得。也可由甲烷的不充分氧化或由高温裂化石油馏分中制取。
[丙炔]分子式C3H4,分子量40.06。又称甲基乙炔,结构简式CH3-C≡CH。无色气体,存在于石油气的碳三馏分中。熔点-102.7℃,沸点-23.22℃,相对密度(-40/4℃)为0.6911克/厘米3,与空气形成爆炸性混和物,有汞盐存在时,在稀硫酸中可生成丙酮;可聚合成1,3,5-三甲基苯。可由碘甲烷或硫酸二甲酯与乙炔钠或与乙炔的格氏试剂反应制得,或由1,2-二溴丙烷在氢氧化钾的乙醇溶液中反应而制得。
[乙烯基乙炔]分子式C4H4,分子量52.04,无色气体。结构简式CH2=CH-C≡CH。有麻醉性和毒性,刺激粘膜。沸点5℃,密度(%℃)为0.7095克/厘米3。与空气形成爆炸性混和物,爆炸极限为1.7-73.3%(体积)化学性质活动,在空气中非常容易氧化形成爆炸性的过氧化物。容易发生加成反应和聚合反应。用于制备合成橡胶的单体2-氯-1,3-丁二烯。可由乙炔在催化剂存在下自行聚合而成,或将乙炔通过含有氯化亚铜的氯化铵饱和溶液经线性聚合而成。

有芳香气味的挥发性液体。有毒。密度(20/4℃)0.879克/厘米3,熔点5.5℃,沸点80.1℃。不溶于水,溶于乙醇、乙醚、氯仿、二硫化碳、冰醋酸、丙酮等有机溶剂。燃烧时发生光亮而带烟的火焰。其蒸气与空气形成爆炸性混和物,爆炸极限为1.5-8.0%(体积)。由X射线衍射法得知苯分子内的六个碳原子位于同一平面上。六个碳碳键的键长均为(1.40×10-10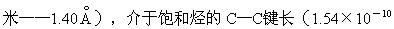
芳香烃的代表,化学性质稳定。不象一般脂肪族不饱和化合物那样容易发生加成反应,而是较易发生取代反应,在适当条件下,苯分子中的氢能被卤素、硝基、磺基所取代;也能与氯气和氢气等起加成反应。苯可用作涂料、橡胶、胶水的溶剂,是制备染料、塑料、合成橡胶、合成树脂、合成纤维、合成药物和农药等的重要原料。
工业上可由焦炉气和煤焦油中的轻油部分中分出,或由催化重整石油馏分分馏得到。
无色、易燃、有芳香气味的挥发性液体。熔点-95℃,沸点110.6℃。密度(20/4℃)0.866克/厘米3,不溶于水,溶于乙醇、乙醚和丙酮等有机溶剂。化学性质与苯相似。其蒸气与空气形成爆炸性混和物,爆炸极限为1.2-7.0%(体积)。可用于制造苯甲酸、苯甲醛、染料、药物和炸药等,并作为重要的溶剂。由分馏煤焦油的轻油部分或由催化重整汽油馏分而制得。
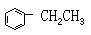
[乙苯]分子式C8H10,分子量106.16。结构简式。无色液体。易燃。沸点为136℃,凝固点-49℃。密度(20℃)0.8672克/厘米3。微溶于水,溶于乙醇、苯、乙醚、四氯化碳等有机溶剂。能脱氢生成苯乙烯。用于生产苯乙烯和甲基苯基甲酮,同时也是制药工业的原料。可由重整的石油碳八馏分中分出,或由苯与乙烯反应制得。
[二甲苯]分子式C8H10,分子量106.16。一般是三种异构体(邻二甲苯、间二甲苯、对二甲苯)体的混和物,亦称混和二甲苯。可分离。工业用的二甲苯中还含有甲苯和乙苯。无色。易挥发、有芳香气味的有毒液体。不溶于水,溶于乙醇、乙醚等有机溶剂。

密度(20/4℃)0.8969克/厘米。
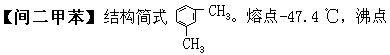
139.3℃。密度(17/4℃)0.867克/厘米3。
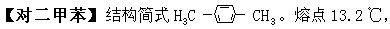
沸点138.5℃。密度(20/4℃)0.861克/厘米3。
由分馏煤焦油的轻油部分或催化重整轻汽油经分馏而制取。也可由甲苯经歧化而制得。
[异丙苯]分子式C9H12,分子量120.19。亦称枯烯。无色液体有芳香气味。熔点-96℃,沸点152-153℃。密度(20/4℃)0.862克/厘米3。与空气形成爆炸性混和物,爆炸极限为1-8%(体积)。不溶于水,溶于乙醇、苯、乙醚和四氯化碳等有机溶剂。在强无机酸的作用下可分解为苯酚和丙酮。脱氢后可生成α-甲基苯乙烯、因此可用于生产苯酚和丙酮、α-甲基苯乙烯,以及异丙基苯过氧化物等。也可用作提高发动机燃料辛烷值的添加剂。可由苯在催化剂存在下用丙烯进行烷基化而制得。
[苯乙烯]分子式C8H8,分子量104.14。结构简式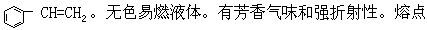
-33℃,沸点146℃。密度(20/4℃)0.9O59克/厘米3。不溶于水,溶于乙醇、乙醚、丙酮和二硫化碳等。在空气中易聚合,也能与其它单体共聚。能发生氢化和卤化反应。它是重要的化工原料,主要用于制备塑料、树脂、合成橡胶等。
由乙苯经催化脱氢制取,或由裂解焦油碳八馏分经萃取蒸馏制得。
[乙烯基甲苯]分子式C9H10、分子量118.7,其异构体为:商品乙烯基甲苯是对位和间位异构体的混和物、熔点-82.5℃,沸点171.45℃。密度0.8970克/厘米3,容易聚合,也能与其它单体共聚。常用以代替苯乙烯。主要用于制备树脂、塑料、橡胶和涂料等。可用乙烯使甲苯烃化生成乙基甲苯三种异构体的混和物,然后分去邻位异构体,再脱氢而制得。
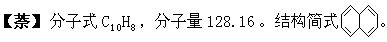
是最简单的稠环化合物,易升华的无色片状晶体,具有特殊的气味。熔点80.2℃,沸点217.9℃。密度(20/4℃)1.162克/厘米3。不溶于水,溶于乙醇、乙醚、苯、甲苯、氯仿、二硫化碳等。能燃烧,燃烧时光弱烟多。在适当条件下,可发生取代反应,如硝化、磺化、卤化等反应,也能和氯、氢等起加成反应。氧化后可生成邻苯二甲酸。主要用于制苯酐、萘酚、聚酯、树脂、染料、杀虫剂及医药的中间体。可由煤焦油的中油部分和石炭酸部分分离出来。也可从裂解焦油碳+部分或柴油馏分分离出来。
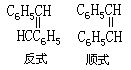
[芪]分子式C14H12,分子量130.24。学名为1.2-二苯乙烯。无色晶体。有反式和顺式两种异构体。芪通常指反式,顺式则称作异芪。反式:熔点124℃,沸点806-307℃。密度(0/4℃固体)1.164克/厘米3。不溶于水,微溶于乙醇,溶于乙醚和苯。异芪是黄色油状液体。熔点1℃,沸点145℃(1732.9帕--13mmHg)。芪的衍生物是染料和萤光增白剂的中间体,芪可由苄基镁化溴和苯甲醛反应制得。当受到紫外光照射时可转变为异芪。
[联苯]分子式D12H10,分子量154.20。结构简式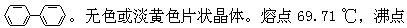 254.25℃。密度(20/4℃)1.041克/厘米3。不溶于水,溶于乙醇、乙醚等有机溶剂。是最稳定的有机化合物,性质象苯,但比苯稳定,可发生氯化、硝化、磺化等反应,也可发生氢化反应。可用于有机合成,用作热交换剂等。可由苯经热裂脱氢制取。
254.25℃。密度(20/4℃)1.041克/厘米3。不溶于水,溶于乙醇、乙醚等有机溶剂。是最稳定的有机化合物,性质象苯,但比苯稳定,可发生氯化、硝化、磺化等反应,也可发生氢化反应。可用于有机合成,用作热交换剂等。可由苯经热裂脱氢制取。
[苊]分子式C12H10分子量154.20。结构简式。无色针状晶体。熔点95℃,沸点279℃。密度(94/4℃)为1.0242克/厘米3。不溶于水,稍溶于乙醇,溶于氯仿、苯、甲苯、无水乙酸和石油醚。可用作染料的中间体,或用于制造塑料、杀虫剂及杀菌剂等。可从煤焦油内分离出来;或由萘与乙烯通过赤热管道时生成,也可由萘与乙炔反应制得。
[二氢茚]分子式C9H10,分子量118.17。结构简式。无色液体。存在于煤焦油内。熔点-51.4℃,沸点176.5℃,相对密度(20/4℃)0.9639克/厘米3。不溶于水,溶于乙醇、乙醚等有机溶剂。化学性质活泼,容易聚合。主要用于制备树脂。可由茚经催化氢化制备。或由邻溴甲基-2-溴乙基苯为原料制备。
[蒽]分子式C14H10。分子量178.22。结构简式。单斜片状晶体,可升华。纯品无色,具有紫色荧光。熔点218℃、沸点342℃、密度(27/4℃)1.25克/厘米3。不溶于水,微溶于乙醚,溶于乙醇、苯、氯仿、二硫化碳、四氯化碳等。主要用于制取蒽醌和染料等。可由煤焦油的蒽油部分分离出来。
[菲]分子式C14H10分子量178.22。结构简式。蒽的异构体,无色有荧光的晶体。存在于煤焦油中。熔点100-101℃,沸点340℃,密度(25/4℃)1.179克/厘米3。真空中可升华。
不溶于水,溶于乙醇、乙醚、无水乙酸、苯、四氯化碳等。溶液有蓝色荧光。用于制造染料和农药等,并用作无烟火药的稳定剂。可由煤焦油的蒽油中分离出来。
[甲醇]分子式CH4O,分子量32.04。结构简式CH3OH。亦称木醇或木精。是最简单的饱和一元醇。无色易燃液体。易挥发。有毒!熔点-97.8℃,沸点64.6℃密度(20/4℃)0.7915克/厘米3。能与水、乙醇、乙醚、苯等大多数有机溶剂互溶。其蒸气与空气形成爆炸性混和物,爆炸极限6.0-36.5%(体积)。燃烧时生成蓝色火焰。易受氧化脱氢生成甲醛。主要用于制取甲醛、喷漆、清漆和农药等。并用作有机物的萃取剂和酒精的变性剂等。还可与汽油混和用作汽车、飞机的燃料。最早由木材干馏制得。现由氢气和一氧化碳的混和物在高温高压下通过催化剂合成。甲醇能使人双目失明。
[乙醇]分子式C2H6O,分子量46.07。结构简式CH3CH2OH。俗称酒精。无色液体,易挥发,有特殊气味,易燃烧。熔点-114.1℃,沸点78.5℃,密度(20/4℃)0.789克/厘米3,能与水和许多有机溶剂互溶。有吸湿性。与水形成共沸混和物,共沸点78.10℃,用蒸馏的方法只能得到95.57%的乙醇,还含4.43%的水、乙醇能溶解许多有机物和无机物,是广泛应用的溶剂。能燃烧,是常用的燃料。其蒸气与空气形成爆炸性混和物,爆炸极限为3.5-18.0%(体积)。用于制染料、涂料、药物、合成橡胶、洗涤剂等。工业制乙醇的传统方法是发酵法,即用粮食发酵酿酒。缺点是消耗大量粮食。现采用石油裂解气的乙烯为原料,在100℃下用浓硫酸吸收,再经水解制得。或用磷酸为催化剂,在300℃和加压下将过量水蒸气通入乙烯中乙烯和水反应制得。
[丙醇]分子式C3H8O,分子量60.09。有正丙醇和异丙醇两种异构体。
[正丙醇]结构简式CH3CH2CH2OH。无色透明液体,有乙醇的气味。熔点-127℃,沸点97.19℃,密度(20/4℃)0.8036克/厘米3。其蒸气与空气形成爆炸性混和物,爆炸极限2.5-8.7%(体积)。主要用作溶剂。在许多情况下可代替沸点较低的乙醇。由乙烯经羰基合成丙醛、再经还原得正丙醇,也可以从低级烷烃的氧化液中分离出来。
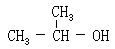
[异丙醇]结构简式。无色透明液体。有乙醇的气味。熔点-88℃,沸点82.5℃。密度(20/4℃)0.7851克/厘米3。溶于水、乙醇、乙醚等。其蒸气与空气形成爆炸性混和物,爆炸极限3.8-10.2%(体积)。与水能形成共沸点混和物。主要用于制取丙酮、二异丙醚、醋酸异丙酯和麝香草酚等。从热裂石油气中分离出来的丙烯用浓硫酸吸收后再经水解制得。或用酸性阳离子树脂和硅钨酸均相催化剂使丙烯水合生成异丙醇。
[正丁醇]分子式C4H10O,分子量74.12。结构简式CH3CH2CH2CH2OH。无色液体,有乙醇的气味,蒸气有刺激性,能引起咳嗽。熔点-90℃、沸点117-118℃。相对密度(20/4℃)0.8098克/厘米3。微溶于水,能溶于乙醇、乙醚等有机溶剂。其蒸气与空气形成爆炸性混和物,爆炸极限3.7-10.2%。主要用于合成乙酸丁酯和树脂等,并用作溶剂。工业上用石油裂解气经催化氧化制得,或用含淀粉的物质(如粮食)经发酵生成正丁醇和丙酮,再经分馏制得。
[异丁醇]分子式C4H10O,分子量74.12。结构简式无色透明液体,有特殊气味。熔点-108℃,沸点107℃。密度0.806克/厘米3(15℃)。溶于水、乙醇、乙醚。其蒸气与空气形成爆炸性混和物。用于制增塑剂、防老剂、果子精油、人造麝香和药物。存在于杂醇油中。是合成甲醇时的副产物,也可由异丁醛还原而制得。
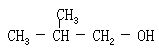
[正戊醇]分子式C5H12O,分子量88.15。亦称伯正戊醇。结构简式CH3CH2CH2CH2CH2OH。无色透明液体。有特殊气味。凝固点-79℃、沸点137.8℃,密度(25/4℃)0.8110克/厘米3。微溶于水,能与乙醇和乙醚互溶。其蒸气与空气形成爆炸性混和物。可用作溶剂,也用作制造若干药物的原料。由正戊烷经氯化和水解而制得。
[异戊醇]分子式C5H12O,分子量88.15。亦称伯异戊醇。结构简式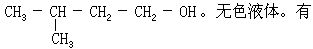
不愉快气味。蒸气有毒。熔点-117℃,沸点132℃。密度(15/4℃)0.813克/厘米3。微溶于水,与乙醇和乙醚混溶。用作溶剂和有色金属矿物浮剂,还用于制药物和摄影药品。由戊烷经氯化和水解后生成的混和醇或杂醇油分馏而制得。
[新戊醇]分子式 C5H12O,分子量88.15。结构简式具有挥发性的结晶。有薄荷油味。熔点53℃。沸点114℃,密度(20/4℃)0.812克/厘米3。微溶于水,能与乙醇、乙醚混溶。杂醇油经精馏。或由戊烷氯化再水解制得。
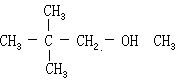
[环己醇]分子式C6H12O,分子量100.16。结构简式无色晶体或液体。有樟脑和杂醇油的气味。熔点25.2℃,沸点161℃,密度(20/4℃)0.9624克/厘米3。有吸湿性。易燃烧。稍溶于水,溶于乙醇、乙醚、苯、二硫化碳、乙酸乙酯和松节油等。用作溶剂和乳化剂。也可用来制己二酸、增塑剂、洗涤剂等。可由苯酚在镍作催化剂条件下加氢制得,或由环己烷催化氧化制得。
[乙二醇]分子式C2H6O2。分子量62.07,结构简式HO-CH2-CH2-OH。俗称甘醇。有甜味的无色粘稠液体。凝固点-13℃、沸点197.6℃,密度(20/4℃)1.1135克/厘米3、吸湿性强。能与水、乙醇和丙酮等混溶。可较大地降低水的冰点。常作为汽车和飞机的抗冻剂。用于制取树脂、合成纤维(的确良)、增塑剂、炸药和化妆品等。可由环氧乙烷水合、氯乙醇水解或1,2-二氯乙烷水解制得。
[丙三醇]分子式C3H8O3,分子量92.09,结构简式

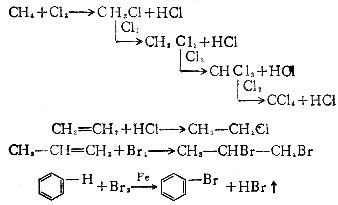
[自由基反应]化合物中键的断裂以对称的方式(即均裂),产生带有单个价电子的原子或基团称作自由基(即游离基)这个阶段叫“引发”。由“引发”阶段产生的自由基与反应体系中电子完全配对的分子反应,生成新的分子和新的自由基。如甲烷和卤素生成一卤甲烷的取代反应:
链引发:X∶X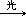 X·+·X
X·+·X
链锁反应:X·+H∶CH3→·CH3+H∶X
X∶X+·CH3→X∶CH3+·X
终止:X·+·X→X∶X
H3C·+·CH3→H3C∶CH3
X·+·CH3→X∶CH3
自由基反应通常在气相、高温或光照下进行。若在液相进行,不受反应介质的影响。
[离子型反应]通过共价键的异裂而发生的反应叫离子型反应。如:
R|∶X+OH-→R-OH+∶X-
卤代烷水解,醇的卤代,芳香烃及其衍生物的硝化、磺化、卤代反应等。烯烃双键上的加成,酯的水解,醛和酮的加成等多是离子型反应。如取代反应:
(CH3)3CBr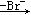 (CH3)3C+
(CH3)3C+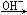 (CH3)3COH
(CH3)3COH
在离子型反应中,不一定形成碳正(或负)离子中间产物。另外,在不同条件下,许多反应既可以按离子型历程进行,也可以按自由基历程进行。如乙烯和氯气反应:在温度363-403K的气相条件下,该反应按自由基历程进行。CH2=CH2+ Cl· →CH2Cl-CH2·CH2Cl-CH2· +Cl2→CH2ClCH2Cl+Cl·若用CH2ClCH2Cl作溶剂,FeCl3为催化剂,在温度约343K的液相条件下,这个反应按离子型历程进行:
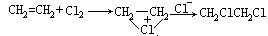
[亲电反应]缺电子试剂(亲电试剂)进攻反应物电子云密度较大的部位而引起的反应叫亲电反应。如:
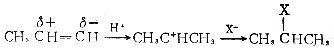
[亲核反应]亲核试剂与有机物的反应叫做亲核反应。如丙酮和氢氰酸的加成反应。
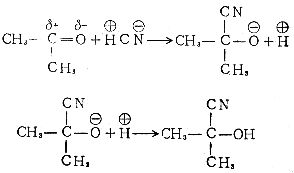
[取代反应]有机物分子中的一种原子或原子团被其它原子或原子团所代替的反应叫取代反应。根据反应历程,可将取代反应分成以下几类:
自由基反应H3C-H+Cl·→CH3Cl+H·
亲核反应CH3-CH2-OH+Br-
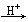 CH3-CH2-Br+OH-
CH3-CH2-Br+OH-
亲电反应C6H6+N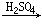 C6H5NO2+H+
C6H5NO2+H+
[硝化反应]简称硝化,一般是指向有机物分子中引入硝基的反应。通常是合成炸药、合成染料、合成药物的重要反应。硝化剂常用浓硝酸和浓硫酸的混和物。苯及其衍生物的硝化是常见的重要的硝化反应。
C6H6+HO-NO2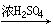 C6H5-NO2+H2O
C6H5-NO2+H2O
甲基是邻对位定位基,所以甲苯的硝化生成2,4,6-三硝基甲苯,而且比苯的硝化容易进行。
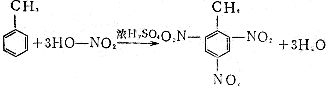
[卤化反应]简称卤化,通常是指向有机物分子中引入卤素原子,形成C-X键的反应。卤化可以通过取代反应卤代反应来进行,也可以通过加成反应来进行。很多烃及其衍生物都能发生卤化反应。例如:
[磺化反应]简称磺化,通常是指向有机物分子中引入磺酸基的反应。磺化可分为直接磺化和间接磺化两种。直接磺化法如苯的磺化。
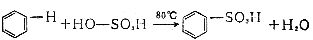
高级烷烃与发烟硫酸或三氧化硫共热,也可发生磺化反应:
R─H+HO-SO3H→R─SO3H+H2O
间接磺化法是指有机物分子中的活泼的取代基被磺酸基取代。如卤代烃与亚硫酸钠在高温高压下反应,生成磺酸盐。
R─X+Na2SO3→R─SO3Na+NaX
[氨化反应]简称氨化,系指向有机物分子中引入氨基的反应。引入氨基有还原法和氨解法。还原法如硝基苯经还原生成苯胺
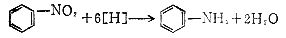
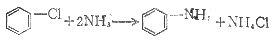
氨解法如氯苯与氨作用
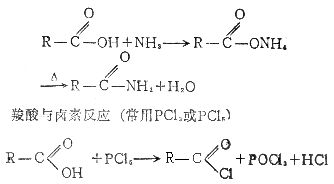
[酰化反应]向有机物分子中羰基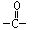 的碳原子上引入其它原子或基团(非烃基和羟基)的反应叫酰化。酰化的结果是酰基
的碳原子上引入其它原子或基团(非烃基和羟基)的反应叫酰化。酰化的结果是酰基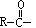 与其它原子或基团直接相连。最常见的酰化反应是羧酸分子中羧基上的羟基被卤素、氨基等取代。如羧酸与氨反应
与其它原子或基团直接相连。最常见的酰化反应是羧酸分子中羧基上的羟基被卤素、氨基等取代。如羧酸与氨反应
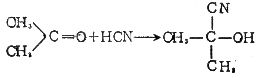
[氰化反应]简称氰化。向有机物分子中引入氰基的反应叫氰化。它可以通过取代或加成反应来实现,
如:
[同系列]结构相似,分子组成上相差一个或若干个“CH2”原子团的一系列化合物称为同系列。同系列中的各个成员称为同系物。由于结构相似,同系物的化学性质相似;它们的物理性质,常随分子量的增大而有规律性的变化。
[同系物]结构相似,分子组成上相差一个或若干个“CH2”原子团,通式相同的化合物互称为同系物。如烷烃系列中的甲烷、乙烷、丙烷、正丁烷等互称为同系物。
[烃]由碳和氢两种元素构成的一类有机化合物,亦称“碳氢化合物”。种类很多,按结构和性质,可以分类如下:

[开链烃]分子中碳原子彼此结合成链状,而无环状结构的烃,称为开链烃。根据分子中碳和氢的含量,链烃又可分为饱和链烃(烷烃)和不饱和链烃(烯烃、炔烃)。
[脂肪烃]亦称“链烃”。因为脂肪是链烃的衍生物,故链烃又称为脂肪烃。
[饱和烃]饱和烃可分为链状饱和烃即烷烃(亦称石蜡烃)和另一类含有碳碳单键而呈环状的饱和烃即环烷烃(参见闭链烃)。
[烷烃]即饱和链烃,亦称石蜡烃。通式为CnH2n+2(n≥1),烷烃中的含氢量已达到饱和。烷烃中最简单的是甲烷,是天然气和沼气的主要成分,烷烃主要来源是石油、天然气和沼气。
[不饱和烃]系分子中含有“C=C”或“C≡C”的烃。这类烃也可分为不饱和链烃和不饱和环烃。不饱和链烃所含氢原子数比对应的烷烃少,化学性质活动,易发生加成反应和聚合反应。不饱和链烃又可分为烯烃和炔烃。不饱和环烃可分为环烯烃(如环戊二烯)和环炔烃(如苯炔)。
[烯烃]系分子中含“C=C”的烃。根据分子中含“C=C”的数目,可分为单烯烃和二烯烃。单烯烃分子中含一个“C=C”,通式为CnH2n,其中n≥2。最重要的单烯烃是乙烯H2C=CH2,次要的有丙烯CH3CH=CH2和1-丁烯OH3CH2CH=CH2。单烯烃简称为烯烃,烯烃的主要来源是石油及其裂解产物。
[二烯烃]系含有两个“C=C”的链烃或环烃。如1,3-丁二烯。2-甲基-1,3-丁二烯、环戊二烯等。二烯烃中含共轭双键体系的最为重要,如1,3-丁二烯、2-甲基-1,3-丁二烯等是合成橡胶的单体。
[炔烃]系分子中含有“C≡C”的不饱和链烃。根据分子中碳碳叁键的数目,可分为单炔烃和多炔烃,单炔烃的通式为CnHn-2,其中n≥2。炔烃和二烯烃是同分异构体。最简单、最重要的炔烃是乙炔HC≡CH,乙炔可由电石和水反应制得。
[闭键烃]亦称“环烃”。是具有环状结构的烃。可分为两大类,一类是脂环烃(或称脂肪族环烃)具有脂肪族类的性质,脂环烃又分为饱和环烷 其中n≥3。环烷烃和烯烃是同分异构体。环烷烃存在于某些石油中,环烯烃常存在于植物精油中。环烃的另一类是芳香烃,大多数芳香烃是有苯环结构和芳香族化合物的性质。
其中n≥3。环烷烃和烯烃是同分异构体。环烷烃存在于某些石油中,环烯烃常存在于植物精油中。环烃的另一类是芳香烃,大多数芳香烃是有苯环结构和芳香族化合物的性质。
[环烷烃]在环烃分子中,碳原子间以单键相互结合的叫环烷烃,是饱和脂环烃。具有三环和四环的环烷烃,稳定性较差,在一定条件下容易开环。五环以上的环烷烃较稳定,其性质与烷烃相似。常见的环烷烃有环丙烷、环丁烷、环戊烷、环己烷等。
[芳香烃]一般是指分子中含有苯环结构的烃。根据分子中所含苯环的数目以及苯环间的联结方式,可分为单环芳香烃、多环芳香烃、稠环芳香烃等。单环芳香烃的通式为CnH2n-6,其中n≥6,单环芳香烃中重要的有苯
[稠环芳香烃]分子中含有两个或多个苯环,苯环间通过共用两个相
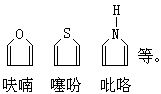
[杂环化合物]分子中含有碳原子和氧、氮、硫等其它原子形成环状结构的化合物叫杂环化合物。其中以五原子和六原子的杂环较稳定。具有芳香性的称作芳杂环,如:

[卤代烃]烃分子中一个或多个氢原子被卤素原子取代而形成的化合物称为卤代烃。根据取代上去的不同卤素原子可分为氟代烃、氯代烃、溴代烃、碘代烃等。根据分子中卤素原子的数目,可分为一卤代烃和多卤代烃。根据烃基种类的不同,可分为饱和卤代烃即卤代烷烃、不饱和卤代烃即卤代烯烃和卤代炔烃、卤代芳香烃等,例如氯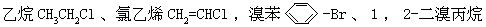
CH3-CHBr-CH2Br等。
[醇]烃分子中的一个或几个氢原子被羟基取代后的产物称为醇(若苯环上的氢原子被羟基取代后的生成物属于酚类)。根据醇分子中羟基的数目,可分为一元醇、二元醇、三元醇等,根据醇分子中烃基的不同,可分为饱和醇不饱和醇和芳香醇。由于跟羟基所连接的碳原子的位置,又可分为伯醇如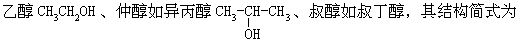
(CH3)3COH。醇类一般呈中性,低级醇易溶于水,多元醇带甜味。醇类的化学性质主要有氧化反应、酯化反应、脱水反应、与氢卤酸反应、与活动金属反应等。
[芳香醇]系芳香烃分子中苯环的侧键上的氢原子被羟基取代而成的物质。如苯甲醇(亦称苄醇)。
[酚]芳香烃分子中苯环上的氢原子被羟基取代而成的化合物称作酚类。根据酚分子中所含羟基的数目,可分为一元酚,二元酚和多元酚等,如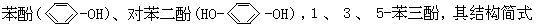
 溶液呈变色反应。酚具有较弱的酸性,能与碱反应生成酚盐。酚分子中的苯环受羟基的影响容易发生卤化、硝化、磺化等取代反应。
溶液呈变色反应。酚具有较弱的酸性,能与碱反应生成酚盐。酚分子中的苯环受羟基的影响容易发生卤化、硝化、磺化等取代反应。
[醚]两个烃基通过一个氧原子连结而成的化合物称作醚。可用通式R-O-R'表示。若R与R'相同,叫简单醚,如甲醚CH3-O-CH3、乙醚C2H5-O-C2H5等;若R与R'不同,叫混和醚,如甲乙醚CH3-O-C2H5。若二元醇分子
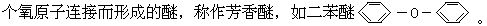
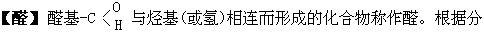 子中醛基的数目,可分为一元醛、二元醛等;根据分子中烃基的不同,可分
子中醛基的数目,可分为一元醛、二元醛等;根据分子中烃基的不同,可分

相应的伯醇氧化制得。醛类中羰基可发生加成反应,易被较弱的氧化剂如费林试剂、多伦试剂氧化成相应的羧酸。重要的醛有甲醛、乙醛等。
[芳香醛]分子中醛基与苯环直接相连而形成的醛,称作芳香醛。如苯甲醛。


[羧酸]烃基或氢原子与羧基连结而形成的化合物称为羧酸,根据羧酸分子中羧基的数目,可分为一元酸、二元酸、多元酸等。一元酸如乙酸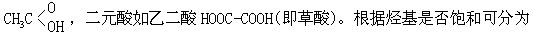
饱和酸如丙酸CH3CH2COOH、不饱和酸如丙烯酸CH2=CH-COOH等。羧酸还可以分为脂肪酸、脂环酸和芳香酸等。脂肪酸中,饱和的如硬脂酸C17H35COOH、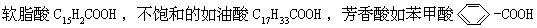 等。
等。
[羧酸衍生物]羧酸分子中羧基里的羟基被其它原子或原子团取代而形成的化合物叫羧酸衍生物。如酰卤、酰胺、酸酐等。
[酰卤]系羧酸分子中羧基上的羟基被卤素原子取代而形成的化合物。等。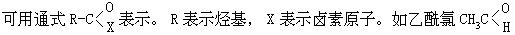
[酰胺]系羧酸分子中羧基上的羟基被氨基-NH2或者是被取代过的氨基 等。
等。
[酸酐]两个分子的一元羧酸分子间失水或者二元羧酸分子内失水而形成的化合物,称作酸酐。如两个乙酸分子失去一个水分子形成乙酸酐(CH3-
[酯]羧酸分子中羧基上的羟基被烷氧基-O-R'取代而形成的化合物称
[油脂]系高级脂肪酸甘油酯的总称。在室温下呈液态的叫油,呈固态的叫作脂肪。可用通式表示:若R、R'、R″相同,称为单甘油酯;若R、R'、R″不同,称为混甘油酯。天然油脂大都是混甘油酯。
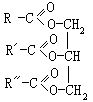
[硝基化合物]系烃分子中的氢原子被硝基-NO2取代而形成的化合物,可用通式R-NO2表示,R可以是烷基,也可以是苯环。如硝基乙烷CH3CH2NO2、
[胺]系氨分子中的氢原子被烃基取代后而形成的有机化合物。根据取 根据烃基结构的不同,可分为脂肪胺如甲胺CH3NH2、二甲胺CH3-NH-CH3和芳香胺如苯胺C6H5-NH2、二苯胺(C6H5)2NH等。也可以根据氨基的数目分为一元胺、二元胺、多元胺。一元胺如乙胺CH3CH2NH2,二元胺如乙二胺H2N-CH2-CH2-NH2,多元胺如六亚甲基四胺(C6H2)6N4。胺类大都具有弱碱性,能与酸反应生成盐。苯胺是胺类中重要的物质,是合成染料,合成药物的原料。
根据烃基结构的不同,可分为脂肪胺如甲胺CH3NH2、二甲胺CH3-NH-CH3和芳香胺如苯胺C6H5-NH2、二苯胺(C6H5)2NH等。也可以根据氨基的数目分为一元胺、二元胺、多元胺。一元胺如乙胺CH3CH2NH2,二元胺如乙二胺H2N-CH2-CH2-NH2,多元胺如六亚甲基四胺(C6H2)6N4。胺类大都具有弱碱性,能与酸反应生成盐。苯胺是胺类中重要的物质,是合成染料,合成药物的原料。
[腈]系烃基与氰基(-CN)相连而成的化合物。通式为R-CN,如乙腈CH3CN。
[重氮化合物]大多是通式为R-N2-X的有机化合物,分子中含有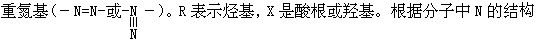
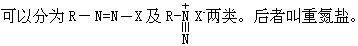
[重氮盐]是一种重氮化合物,其中以芳香族重氮盐最为重要。可用 化学性质活动,是制取偶氮染料的中间体。
化学性质活动,是制取偶氮染料的中间体。
[偶氮化合物]分子中含有偶氮基(-N=N-)的有机化合物。用通式R-N=N-R表示,其中R是烃基,偶氮化合物都有颜色,有的可作染料。如偶氮
[磺酸]系烃分子中的氢原子被磺酸基-SO3H取代而形成的化合物,可用RSO3H表示。脂肪族磺酸的制备常用间接法,而芳香族磺酸可通过磺化反应直接制得。磺酸是强酸,易溶于水,芳香族磺酸是合成染料、合成药物的重要中间体。
[氨基酸]系羧酸分子中烃基上的氢原子被氨基取代而形成的化合物。根据氨基取代的位置可分为α-氨基酸、β-氨基酸、γ-氨基酸等。α-氨基酸中的氨基在羟基相邻的碳原子上。α-氨基酸是组成蛋白质的基本单位。蛋白质经水解可得到二十多种α-氨基酸,如甘氨酸、丙氨酸、谷氨酸等,大多是L-型a-氨基酸。在人体所需要的氨基酸中,由食物中的蛋白质供给的,如赖氨酸、色氨酸、苯丙氨酸、苏氨酸等称为“必需氨基酸”,象甘氨酸、丝氨酸、丙氨酸、谷氨酸等可以从其它有机物在人体中转化而得到,故称为“非必需氨基酸”。
[肽]系一分子氨基酸中的氨基与另一分子氨基酸中的羧基缩合失去水分子后而形成的化合物。两个氨基酸分子形成的肽叫二肽,如两个分子氨基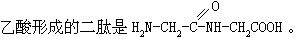
[多肽]由多个a-氨基酸分子缩合消去水分子而形成含有多个肽键-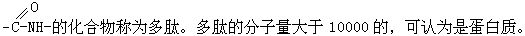
[蛋白质]亦称朊。一般分子量大于10000。蛋白质是生物体的一种主要组成物质,是生命活动的基础。各种蛋白质中氨基酸的组成、排列顺序、肽链的立体结构都不相同。目前已有多种蛋白质的氨基酸排列顺序和立体结构搞清楚了。蛋白质按分子形状可分为纤维状蛋白和球状蛋白。纤维蛋白如丝、毛、发、皮、角、蹄等,球蛋白如酶、蛋白激素等。按溶解度的大小可分为白蛋白、球蛋白、醇溶蛋白和不溶性的硬蛋白等。按组成可分为简单蛋白和复合蛋白,简单蛋白是由氨基酸组成,复合蛋白是由简单蛋白和其它物质结合而成的,如蛋白质和核酸结合生成核酸蛋白,蛋白质与糖结合生成糖蛋白,蛋白质与血红素结合生成血红蛋白等。
[糖]亦称碳水化合物。多羟基醛或多羟基酮以及经过水解可生成多羟基醛或多羟基酮的化合物的总称。糖可分为单糖、低聚糖、多糖等。
[单糖]系不能水解的最简单的糖,如葡萄糖(醛糖)
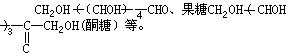
[低聚糖]在水解时能生成2-10个分子单糖的糖叫低聚糖。其中以二糖最重要,如蔗糖、麦芽糖、乳糖等。
[多聚糖]亦称多糖。一个分子多聚糖水解时能生成10个分子以上单糖的糖叫多聚糖,如淀粉和纤维素,可用通式(C6H10O5)n表示。n可以是几百到几千。
[高分子化合物]亦称“大分子化合物”或“高聚物”。分子量可高达数千乃至数百万以上。可分为天然高分子化合物和合成高分子化合物两大类。天然高分子化合物如蛋白质、核酸、淀粉、纤维素、天然橡胶等。合成高分子化合物如合成橡胶、合成树脂、合成纤维、塑料等。按结构可分为链状的线型高分子化合物(如橡胶、纤维、热塑性塑料)及网状的体型高分子化合物(如酚醛塑料、硫化橡胶)。合成高分子化合物根据其合成时所经反应的不同,又可分为加聚物和缩聚物。加聚物是经加聚反应生成的高分子化合物。如聚乙烯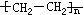 、聚氯乙烯
、聚氯乙烯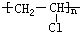 聚丙烯
聚丙烯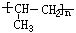 等。缩聚物是经缩聚反应生成的高分子化合物。如酚醛塑料、尼龙66等。
等。缩聚物是经缩聚反应生成的高分子化合物。如酚醛塑料、尼龙66等。
[杂化轨道理论]同一原子中能量相近的原子轨道,在成键时组合成成键能力更强的新轨道的过程,称作原子轨道的杂化。形成的新轨道称作杂化轨道。有几条原子轨道参加杂化就能得到几条杂化轨道。杂化轨道理论是在电子配对为基础的价键理论上提出并发展的。杂化轨道理论能很好地解释有机化合物的分子空间结构问题。例如,碳原子最外层的电子排布为2s22p2,有两个未成对电子,按电子配对法只能形成两个共价键,而两个共价键的键角应是90°,但实际上甲烷分子中4个C-H键完全相同,键角是109°28′。杂化理论认为,碳原子成键时2s中的1个电子吸收能量被激发到2p轨道,形成4个未成对电子,然后1个s轨道和3个p轨道组合形成4个等价的sp3杂化轨道,分别与4个氢原子形成4个共价键,键角都是109°28′,是正四面体构型。
[σ键]两个原子轨道沿键轴方向重叠而形成的一种以两个原子核之间的直线为对称轴的共价键叫σ键。构成σ键的电子叫σ电子。σ键是原子轨道沿轴向重叠的,具有较大的重叠程度,因而比较稳定。σ键可以自由旋转,而不影响电子云的分布。
[π键]成键原子的未杂化的p轨道,通过平行侧向重叠所形成的共价键叫π键。两个p轨道侧向重叠,其重叠程度比轴向重叠的σ键小,稳定性不如σ键,两个p轨道在平行时才能较大地重叠,当形成π键的两个原子以核间轴为轴相对旋转时,会使p轨道重叠程度减小,导致π键的破坏,π键电子云密集在核间轴平面的上面和下面两部分,受两核的吸引力较弱,有较大的流动性。
[大π键]大π键通常是指苯环的6个成环碳原子各以1个未杂化的2p轨道彼此重叠(侧向)形成的封闭的共轭π键。
[单键]分子中两个成键原子各以1个未成对电子形成一对共用电子对,这样的共价键叫单键。单键通常都是σ键。
[双键]分子中两个原子间共用两对电子所形成的共价键叫双键。双键不是单键的简单加和,通常都是由1个σ键和1个π键构成的。如乙烯“C=C”键键能是598千焦/摩尔,小于乙烷“C-C”键键能(347千焦/摩尔)的两倍。乙烯分子中的两个碳原子各形成3个sp2杂化轨道,两个碳原子间形成1个σ键,两个碳原子各以σ键再结合两个氢原子,这些σ键同处于一个平面上,各σ键间的键角约120°,而两个未杂化的p轨道垂直于该平面并侧向重叠形成π键。双键中的σ键不能象单键的σ键那样自由旋转。其中的π键易被破坏发生加成反应。
[叁键]分子中两个原子间共用三对电子所形成的共价键叫叁键。参键不是单键或单键与双键的简单加和。叁键通常是由1个σ键和2个π键构成。如乙炔分子中两个碳原子各形成两个sp杂化轨道,两个碳原子间形成1个σ键,两个碳原子各以σ键再结合1个氢原子,这些σ键同处于一条直线上。两个碳原子各以两个未杂化而且相互垂直的P轨道,平行地侧向重叠形成两个π键,π键易被破坏发生加成反应。
[苯环结构]苯环中每个碳原子各以3个电子按sp7杂化而形成三个σ键(1个C-H键和两个C-C键)这三个σ键之间均为120°,6个碳原子处于同一平面上并形成正六边形。每个碳原子各剩余1个未杂化的p轨道,垂直于苯环的平面,彼此平行侧向重叠,形成一个π电子云完全平均化的闭合π键,这种大π键在通常情况下是稳定的。
[诱导效应]分子中两个电负性不同的原子或原子团成键时,由于它们吸引电子的能力不同,就会产生永久偶极,这种极化作用可以沿σ键传递下去,这种作用叫诱导效应。诱导效应的传递由一个原子传至下一个原子,向同一方向,由近及远,明显减弱,超过三个原子时可以忽略不计。如氯乙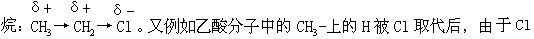 的电负性强,产生诱导效应,导致生成物酸性增强:
的电负性强,产生诱导效应,导致生成物酸性增强:
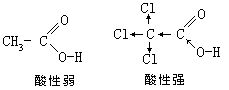
[共轭效应]由一个单键隔开的两个双键,如1,3-丁二烯CH2=CH-CH=CH2,叫共轭双键。含共轭双键的分子体系称为共轭体系。由于相邻的p轨道电子云互相发生作用,使键电子云分布趋于平均化,形成统一的整体。这种电子云分布平均化的结果,使得单键和双键的性质发生变化,与单独存在的单键和双键不同。这种变化叫共轭效应。共轭效应主要是通过π键传递,能从共轭体系的一端传递到较远的另一端,例如对硝基苯酚。
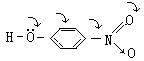
羟基中的氧原子上的负电荷能分散到包括硝基在内的共轭体系中,使得羟基的H-O键易断裂,其酸性比苯酚强得多。如2,4,6-三硝基苯酚,由于苯环上引入了3个硝基,使其酸性与无机强酸相近。取代基对有机物的影响往往同时具有共轭效应和诱导效应,这两种效应的方向可以一致,也可以不一致。如对氯苯酚中氯原子的诱导效应和把p电子云分散到整个共轭体系中的共轭效应在方向上是不一致的。
[定位效应]苯环上原有取代基对新引入取代基位置的影响叫定位效应。苯环取代基的定位效应,可用诱导效应和共轭效应解释。取代基对苯环的诱导效应,导致苯环上与带取代基的碳原子上的π键电子云发生移动,使一些电子云分布相对较大的位置上活性较大,亲电取代反应主要发生在这些部位上,即为新导入的取代基确定了位置。苯环上原有取代基也叫定位基,邻对位定位基一般使苯环活化,取代反应比苯易于进行。常见的邻对位定位基有:-NH2、-OH、-NHCOCH3-CH3(-R)、-X。一般邻对位定位基与苯环直接相连的原子具有未共用电子对(如O、N、卤素)或烷基。间位定位基一般使苯环钝化,取代反应比苯难于进行。取代反应主要发生在间位上。常见的间位定位基有-NO2、-CN、-SO3H、-CHO-COOH、-NR3+等。这类取代基直接和苯环相连的原子上一般有重键或带有正电荷。
[同分异构]分子组成相同,但分子结构和性质不同的化合物叫做同分异构体。这种现象称为同分异构现象。
[碳架异构]分子组成相同,但分子中碳原子相互连接的顺序不同的化合物叫碳架异构体。如C5H12有三种异构体:
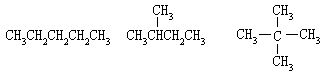
碳架异构只涉及到碳原子的结合顺序,不涉及到分子中各原子在空间的排列和定向。随分子中碳原子数的增多,碳架异构的数目也随之增多。
[位置异构]分子组成相同,但分子中的取代基或官能团(包括C≡C和C≡C键)在碳链或碳环上的位置不同的化合物叫做位置异构体。如丙醇有 基或官能团的位置,通常是对碳架结构相同的化合物而言的。
基或官能团的位置,通常是对碳架结构相同的化合物而言的。
[类别异构]分子组成相同,但由于分子中各种原子结合的方式或顺序不同,因而具有不同官能团的化合物叫类别异构体。如乙醇和甲醚,乙酸和甲酸甲酯,丙醛和丙酮等互称为类别异构体。类别异构体与碳架异构体和位置异构体有很大的不同。类别异构体在化学性质上往往有本质的差别。
[顺反异构]顺反异构即几何异构。通常存在于含有双键或环架结构的分子中,双键中的π键不能旋转,环架结构也阻碍了C-C单键的旋转,不同取代基在空间可形成不同的分布而产生异构,顺反异构分顺式和反式两种。若相同的原子或取代基在双键或碳架规定平面的同一侧叫顺式,若位于两侧叫反式。如含C=C双键和ab两种原子团
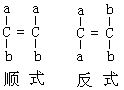
具体的物质象丁烯二酸,有顺丁烯二酸和反丁烯二酸
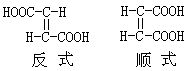
含环架结构的象1,4一二甲基环乙烷:
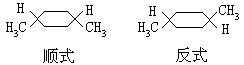
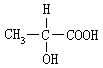
[对映异构]对映异构即旋光异构。在分子中,与四个不同原子或原子团直接相连的碳原子叫做不对称碳原子,如乳酸分子中,与甲基、羟基、羧基、氢原子直接相连的碳原子,不对称碳原子周围的四个不同原子或原子团可以有两种互为镜象关系,但不能彼此重合的四面体空间构型,这两种构型互为对映异构体。对映异构体的物理及化学性质都相同,但在一定条件下的旋光方向相反。使偏振光左旋的为“左旋体”,使偏振光右旋的为“右旋体”,左旋体用L-或(-)-表示,右旋体用D-或(+)-表示。乳酸对映异构体费歇尔投影式可表示如下:
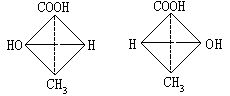
若将乳酸的左旋体和右旋体等量混和后,用“(±)-乳酸”表示。由于它们对偏振光的作用相互抵消,故不再有旋光性,叫外消旋体。
[官能团]具有特定结构和性质,在有机物分子中容易发生化学反应并能决定有机化合物主要化学性质的原子或原子团。
[烃基]烃分子中去掉一个或几个氢原子剩余的原子团叫做烃基。根据去掉的氢原子的数目,可将烃基分为一价基、二价基、三价基等;根据烃基对应的烃可分为烷基、乙烯基、苯基等。
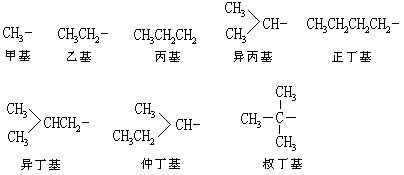
[烷基]从烷烃分子中去掉一个氢原子后得到的烃基叫烷基。烷基是一价基,可用通式CnH2n+1来表示,习惯上用字母R代表,常见的有:
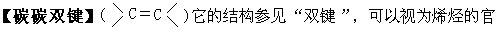 能团,双键中的π键容易打开,发生加成反应,也可以发生聚合反应。
能团,双键中的π键容易打开,发生加成反应,也可以发生聚合反应。
 团,炔烃的不饱和性比烯烃更大,叁键中的两个π键可分两步打开,发生加成反应,最后得到饱和的化合物。炔烃也可以发生聚合反应。
团,炔烃的不饱和性比烯烃更大,叁键中的两个π键可分两步打开,发生加成反应,最后得到饱和的化合物。炔烃也可以发生聚合反应。
[乙烯基]乙烯分子中去掉一个氢原子剩余的部分叫做乙烯基(CH2=CH-),如乙烯基乙炔(CH2=CH-C=CH)、苯乙烯(C6H5CH=CH2)等分子中都含有乙烯基。
[苯基]苯分子去掉一个氢原子剩余的部分(C6H5-)叫做苯基,如硝基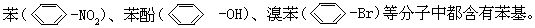
[苯甲基]亦称“苄基”。甲苯分子中甲基上去掉一个氢原子剩余的 等分子中都含有苯甲基。
等分子中都含有苯甲基。
[苄基]见苯甲基条。
[羟基]亦称“氢氧基”,由H和O组成的一价原子团(-OH)。在无机碱类、无机含氧酸及有机化合物的醇类、芳香醇类、酚类、羧酸等分子中都含有这种官能团。
[氢硫基]见巯基条。
[巯基]亦称“氢硫基”,由H和S组成的一价原子团(-SH),如甲硫醇(CH3-SH)、硫酚(C6H5SH)等分子中含有这种原子团。
[氢硫基]见巯基条。
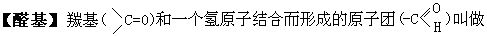
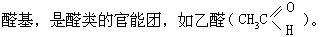
应。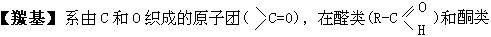
 如丙醛与氢气加成生成1-丙醇,丙酮与氢气加成生成2-丙醇等。
如丙醛与氢气加成生成1-丙醇,丙酮与氢气加成生成2-丙醇等。

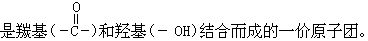
[酰基]无机含氧酸或羧酸分子中去掉羟基(-OH)后剩余的部分。如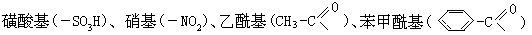 等。
等。
[硝基]亦称“硝酰基”(-NO2)。硝基可以看成是硝酸(HO-NO2)分子中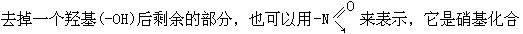 物如硝基甲烷(CH3NO2)、硝基苯(-NO2)等的官能团。
物如硝基甲烷(CH3NO2)、硝基苯(-NO2)等的官能团。
[磺酸基]亦称“磺基”。是硫酸分子中去掉一个羟基后剩余的部分,用-SO3H来表示。磺酸基与烃基的碳原子直接相连时叫做磺酸(RSO3H),R可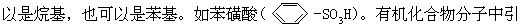 入磺酸基后可增加其酸性,又因为磺酸基是亲水性基团,可增加其水溶性。
入磺酸基后可增加其酸性,又因为磺酸基是亲水性基团,可增加其水溶性。
[氨基]氨分子中去掉一个氢原子后剩余的一价原子团,用-NH2来表示。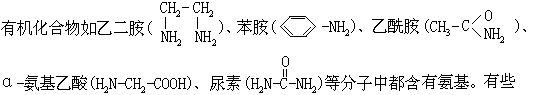
有机物分子中引入氨基后,其碱性增强。
[氰基]亦称“氰根”。由碳、氮两种原子构成的一价原子团,用-C≡N或-CN来表示。无机氰化物及有机腈类物质如丙烯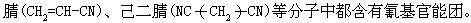
[偶氮基]系基团-N=N-两端都与烃基的碳原子相连的原子团。有机化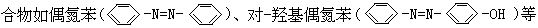 分子中都含有偶氮基。偶氮化合物都有颜色,有的可用作染料。
分子中都含有偶氮基。偶氮化合物都有颜色,有的可用作染料。
[卤原子]卤原子通常是指F、Cl、Br、I等元素。有机化合物如卤代烃、酰卤等分子中都含有卤原子。象溴乙烷(CH3-CH2Br)和乙酰氯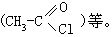
[铁]元素符号Fe,原子序数26,原子量55.847,外围电子排布3d64s2,位于第四周期第Ⅷ族。原子半径124.1皮米,离子半径Fe2+74皮米,Fe3+64皮米,第一电离能764千焦/摩尔,电负性1.8。银白色金属,密度7.86克/厘米3,熔点1535℃,沸点2750℃,常见化合价+2、+3。有良好延展性和传热导电性,纯铁容易磁化,也容易去磁。化学性质较活泼。在干燥空气中较稳定,在潮湿空气中易锈蚀。高温时能跟卤素、氧、硫、硅、磷、碳等化合,红热时跟水蒸气反应生成四氧化三铁和氢气。溶于盐酸和稀硫酸生成亚铁盐和氢气。常温下在浓硫酸或浓硝酸中发生钝化。主要用于炼钢,制造铸铁和锻铁。还原铁粉用于冶金。在古代被发现。在地壳中丰度为4.75%,主要铁矿有磁铁矿、赤铁矿、褐铁矿和菱铁矿等。工业用焦炭还原铁矿石制得。
[钢]指含碳量小于2%的铁碳合金。根据成分不同,又可分为碳素钢和合金钢。根据性能和用途不同,又可分为结构钢、工具钢和特殊性能钢。
[氧化铁]通常指三氧化二铁,化学式Fe2O3,式量159.69,棕红色粉末,俗称铁红。密度5.24克/厘米3,熔点1565℃。不溶于水,不与水反应。跟酸反应,生成铁盐。在高温下可被氢气、一氧化碳等还原成铁。用作颜料、抛光剂、催化剂等。灼烧硫酸亚铁或氢氧化铁制得。
[氧化亚铁]化学式FeO,式量71.85。黑色粉末,密度5.7克/厘米3。不稳定,在空气中加热时迅速被氧化成四氧化三铁,溶于盐酸、稀硫酸生成亚铁盐。不溶于水,不与水反应。在隔绝空气条件下加热草酸亚铁制得:
FeC2O4=FeO+CO+CO2
[四氧化三铁]化学式Fe3O4,式量231.54。铁在四氧化三铁中有两种化合价,经研究证明了Fe3O4是一种铁(Ⅲ)酸盐,即FeⅡFeⅢ[FeⅢO4]。黑色晶体,密度5.18克/厘米3。有磁性,故又称磁性氧化铁。潮湿状态的四氧化三铁在空气中容易氧化成三氧化二铁。不溶于水,溶于酸。用作颜料和抛光剂。磁性氧化铁用于制录音磁带和电讯器材。用红热铁跟水蒸气反应制得。
[氢氧化铁]化学式Fe(OH)3,式量106.87。红棕色无定形粉末,密度3.44-3.6克/厘米3。不溶于水。加热时分解成氧化铁和水。略具两性,碱性强于酸性。新制的易溶于酸,稍加放置后则难溶。新制的能溶于强碱溶液生成铁酸盐。用作颜料、药物和砷的解毒剂。由铁盐溶液跟氨水反应制得。
[氯化铁]化学式FeCl5,式量162.61。亦称三氯化铁。棕黑色六方晶体,密度2.898克/厘米3。在空气中易吸水潮解,易溶于水,由于水解呈黄褐色,显酸性。能跟水形成2-6个水分子的水合物,FeCl3·6H2O是桔黄色晶体。有氧化性。用作氯化试剂、氧化剂、止血剂、催化剂、印刷制版,制备铁盐和染料等。用盐酸跟氧化铁或用氯气跟氯化亚铁反应制得。
[氯化亚铁]化学式FeCl2,式量126.75。绿黄色六方晶体,密度3.16克/厘米3,溶于水和乙醇,由于水解,水溶液显酸性。从饱和溶液析出的晶体是FeCl2·4H2O,浅天蓝色单斜晶体,易潮解。在空气中易被氧化。有还原性。用作还原剂、媒染剂、医药、冶金及污水处理。由过量铁跟盐酸反应制得。
[硫酸亚铁]化学式FeSO4,常见的是含七个结晶水的硫酸亚铁FeSO4·7H2O,俗称绿矾。浅蓝绿色单斜晶体,密度1.898克/厘米3,64℃熔于结晶水。溶于水,水溶液显酸性。在空气中逐渐风化,同时被氧化为黄褐色的碱式铁盐。300℃时失去全部结晶水,无水物是白色粉末。有还原性,易被氧化,如被空气氧化时发生下列反应:
4FeSO4+2H2O+O2=4Fe(OH)SO4
强热时,分解为Fe2O3、SO2和SO3。用作还原剂、媒染剂、除草剂、木材防腐剂、净水剂、煤气净化剂、缺铁性贫血的补血剂、植物的杀菌剂、还可用于制备氧化铁、蓝黑墨水等。由铁跟稀硫酸反应制得。
[绿矾]见硫酸亚铁条。
[黄铁矿]矿物名。又称硫铁矿。主要化学成分为FeS2。等轴晶系,晶体多呈八面体、立方体或五角十二面体。晶面上有条纹。淡黄铜色,有金属光泽,条痕绿黑色。硬度6-6.5,密度4.9-5.1克/厘米3。有弱导电性。主要用于制硫酸。
[硫铁矿]见黄铁矿条。
[氢氧化亚铁]化学式Fe(OH)2,式量89.866。白色固体,难溶于水。密度3.4克/厘米3。受热易分解。溶于酸,不溶于碱。易被氧化。用碱溶液跟亚铁盐溶液反应可制得。但不易制得纯物,因Fe(OH)2在空气中迅速被氧化,变成灰绿色最后变成棕红色的Fe(OH)3。
[硫酸铁]化学式Fe2(SO4)3,式量399.7。浅黄色粉末,密度3.097克/厘米3,在潮湿空气中易潮解,变成棕色溶液。易溶于水,容易水解,溶液显酸性。480℃时分解生成氧化铁和三氧化硫。水合物很多,常见的有九水合物Fe2(SO4)3·9H2O,式量562.01。呈黄色,密度 2.1克/厘米3。在酸性溶液中有较强氧化性,可溶解铁、铜等。用于制颜料、药物,还用作媒染剂、净水剂。用氧化物或氢氧化铁跟硫酸反应制得。
[硝酸铁]化学式Fe(NO3)3·9H2O,式量404.02。无色或浅紫色单斜晶体。密度1.63克/厘米3,47.2℃溶于结晶水,在125℃分解。易潮解,溶于水和乙醇。微溶于硝酸。有氧化性。水溶液在紫外线照射下生成硝酸亚铁和氧气。用作化学试剂、催化剂、媒染剂、铜着色剂、医药。用氧化铁跟硝酸反应制得。
[硫化亚铁]化学式FeS,式量87.91。深棕色或黑色固体。密度4.74克/厘米3。不溶于水。溶于非氧化性酸(盐酸或稀硫酸)产生硫化氢。主要用于制备硫化氢。用铁粉、硫粉混合共热制得。
[铁钾矾]化学式K2SO4·Fe2(SO4)3·24H2O,或写作KFe(SO4)2·12H2O。又称硫酸铁钾,俗称铁矾。硫酸铁和硫酸钾的复盐。无色或淡紫色晶体。密度1.83克/厘米3,33℃熔于结晶水。在干燥空气中逐渐风化生成黄白色粉状物。溶于水,难溶于乙醇。80℃时分解为硫酸和碱式硫酸铁钾。主要用作媒染剂。将硫酸钾与硫酸铁溶液混合后结晶制得。
[铁矾]见铁钾矾条。
[硫酸亚铁铵]化学式(NH4),SO4·FeSO4·6H2O,式量392.18。俗称莫尔盐。是一种复盐。透明淡蓝绿色单斜晶体。密度1.864克/厘米3。100-110℃失去结晶水。有潮解性,溶于水,不溶于乙醇,在空气中比硫酸亚铁稳定。有还原性。用作化学试剂、医药。还用于冶金,电镀等。由硫酸亚铁溶液与硫酸铵溶液混合后,经浓缩、结晶制晶。
[莫尔盐]见硫酸亚铁铵条。
[铁锈]铁和铁基合金在含有二氧化碳的潮湿空气中受腐蚀生成的红褐色疏松多孔物质。是一种成分不定的混和物,主要成分有氧化铁、水合氧化铁(Fe2O3·xH2O)、水合氧化亚铁等。不溶于水,可溶于酸。
[铁铵矾]化学式(NH4)2SO4·Fe2(SO4)3·24H2O,即硫酸铁铵。式量968.42。无色或淡紫色晶体。密度1.71克/厘米3。230℃时失去结晶水。溶于水,不溶于乙醇。用作化学试剂和媒染剂。由硫酸铁与硫酸铵溶液混合后,浓缩、结晶制得。
[铁合金]炼钢用原料。在炼钢时作为脱氧剂与合金元素添加剂加入钢水中。常用的有硅铁、锰铁、铬铁等。铁合金比纯金属熔点低,比重大,容易加入钢水中。同时生产铁合金比生产纯金属简单经济。所以生产熔炼合金钢时,各合金元素多以铁合金状态加入。
[生铁]铁碳合金。一般把含碳量在2-4.3%的铁碳合金叫做生铁。在高炉冶炼过程中,常将铁矿石和焦炭中的硫、磷、硅等带入生铁内。因而使生铁有脆性。生铁产量的90%用于炼钢,10%用于铸造。
[白口铁]生铁中的一种。含碳量约2.5%,硅在1%以下。白口铁中的碳以碳化铁Fe3C存在。断面呈白色,质硬且脆,不易进行机械加工。主要用炼钢。
[灰口铁]生铁中的一种。含碳量约3%,含硅约2%。灰口铁中碳以片状石墨状态存在。断面呈深灰色。质较软,可进行切削加工。热时容易流动,铸造性能好。较耐磨。强度及延展性差。主要用于铸造。
[球墨铸铁]生铁中的一种。球墨铸铁中碳形成球状石墨。它的抗张强度,延展性都优于灰口铁。硬度高。因此,球墨铸铁可代替一部钢制造内燃机汽缸、汽缸套、大齿轮、金),再加入硅铁、使石墨完全球化。
[合金钢]又叫特种钢。除铁、碳以外,还含有一种或多种一定量的合金元素的钢。合金元素有硅、锰、钼、镍、铬、钒、钛、铌、硼,钨和稀土元素等。按照合金元素种类可分为:镍钢、铬钢、锰钢、钨钢、镍铬钢、硅钢等。按照合金元素的多少可分为:高合金钢(含合金元素10%以上),中合金钢(含5-10%)和低合金钢(含3-5%)。根据用途不同可分为:合金工具钢、合金结构钢和特种合金钢(如不锈钢)等。不同的合金钢具有不同的特性。
[不锈钢]能抵抗空气、水及一般酸、碱、盐等腐蚀作用的合金钢的总称。主要是含铬合金钢。常用的有铬不锈钢(含铬12%以上)和镍铬不锈钢(含铬18%和镍8%)两类。铬在钢中能提高钢的硬度、耐热性和耐腐蚀性,镍在钢中能提高钢的强度和韧性。所以镍铬不锈钢的耐腐蚀性和机械加工性能更优良。广泛用于制汽轮机和化工设备。
[特种钢]见合金钢条。
[赤铁矿]矿物名。主要化学成分为Fe2O3。三方晶系,晶体呈片状或菱面体状集合体,常呈致密块状或肾状。结晶质的赤铁矿呈铁黑至钢灰色;有金属或半金属光泽。胶态赤铁矿呈赭红色,无光泽。条痕均呈樱红色。硬度5.5-6.0。密度5-5.3克/厘米3。产于沉积矿床及各式内生矿床中。是炼铁的重要原料。
[磁铁矿]矿物名。主要化学成分是Fe3O4。等轴晶系,晶体常呈八面体和菱形十二面体、集合体呈粒状或块状。铁黑色,条痕呈黑色。金属光泽或半金属光泽。硬度5.6-6。密度4.9-5.2克/厘米3。有强磁性。生于变质矿床和内生矿床中,氧化后变为赤铁矿或褐铁矿。是炼铁的重要原料。
[钛铁矿]矿物名。主要化学成分为FeTiO3。三方晶系,晶体呈厚板状、菱面体状或不规则粒状。铁黑色或钢灰色。条痕黑色至棕红色。半金属光泽。微带磁性。硬度5-6,密度4.7-5.0克/厘米3。常和磁铁矿共生。是炼钛铁合金和制钛白的主要原料。
[钴]元素符号Co,原子序数27,原子量58.93,外围电子排布3d74s2,位于第四周期Ⅷ族。金属半径125.3皮米,第一电离能763千焦/摩尔,电负性1.8。主要氧化数+1、+3、+4。银白色金属,硬而有延展性,具有铁磁性,密度8.9克/厘米3,熔点1495℃,沸点2870℃。常温下不跟空气,水反应。白热时燃烧生成四氧化三钴,也能分解水蒸气。能跟卤素直接化合。能溶解于盐酸、硫酸和硝酸中。能被氢氟酸,氨水和氢氧化钠溶液缓慢侵蚀。用于制超硬耐热合金、磁性合金和切削工具用合金。同位素60Co是一种放射源,用于医疗、科研和生产中。1735年瑞典人布朗特煅烧钻矿得到钴。主要钴矿有辉钴矿、砷钴矿。先将钴矿转化为氧化钴,然后用铝还原制取钴。
[氯化钴]别名氯化亚钴或二氯化钴。化学式CoCl2,式量129.83。无水物为蓝色六方晶体,结晶水合物中由于结晶水数不同而呈不同颜色。它们的相互转变温度及特征颜色如下:
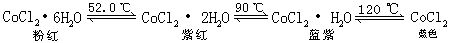
易潮解,易溶于水、乙醇,水溶液呈粉红色。密度3.356克/厘米3,熔点724℃(在氯化氢中),沸点1049℃。用作分析试剂,氨的吸收剂,还用硅胶吸湿情况的指示剂。由钴跟氯气直接反应可制得。
[硝酸钴]别名硝酸亚钴。化学式Co(NO3)2·6H2O,式量291.03。红色晶体。有潮解性。易溶于水和乙醇,微溶于氨水。有强氧化性,与有机物摩擦和撞击能引起燃烧和爆炸。55℃时熔于结晶水。用作分析试剂,测定钾,用于制催化剂,蓝宝石抛光膏等。由钴跟硝酸反应或由碱式碳酸钴跟硝酸反应制得。
[氧化高钴]别名三氧化二钴,化学式Co2O3,式量165.86。灰黑色结晶性粉末。溶于热盐酸或热稀硫酸,分别放出氯气和氧气。不溶于水和醇。熔点895℃(分解)。用作分析试剂,氧化剂,催化剂。还用于制取钴或钴盐。在空气中加热碳酸钴可制得三氧化二钴。
[三氧化二钴]见氧化高钴条。
[镍]元素符号Ni,原子序数28,原子量58.71,外围电子排布3d84s2,位于第四周期第Ⅷ族。金属半径124.6皮米,第一电离能741.1千焦/摩尔,电负性1.8,主要氧化数+2、+3、+4。银白色金属,有良好延展性,具有中等硬度,有铁磁性。密度 8.902克/厘米3,熔点1453℃,沸点2732℃。化学性质较活泼。有较好的耐腐蚀性,室温时在空气中难氧化,不易与浓硝酸反应,能耐碱腐蚀。细镍丝可燃,加热时与卤素反应,在稀酸中缓慢溶解。能吸收相当数量氢气。用于制不锈钢,抗腐蚀合金、蓄电池、化学器皿、陶瓷制品,还用作催化剂。1751年瑞典人克朗斯埃特首先从红砷镍矿制得镍。主要矿物有红砷镍矿、针镍矿等。矿石经煅烧成氧化物后,再用水煤气或炭还原得到镍。
[一氧化镍]别名氧化镍或氧化亚镍,化学式NiO,式量74.71。绿色立方晶体或绿色粉末,密度6.67克/厘米3,熔点1984℃。不溶于水或醇。可溶于酸或氨水。用作催化剂、电子元件材料、蓄电池材料。搪瓷涂料、制备镍盐。用镍在空气中加热或者用草酸镍在隔绝空气条件下加热分解制得。
[氧化镍]见一氧化镍条。
[氧化亚镍]见一氧化镍条。
[硫酸镍]化学式NiSO4·7H2O,式量280.88。亮绿色菱形晶体,俗称翠矾。密度1.948克/厘米3。于31.5℃时失去1分子结晶水,99℃时熔于结晶水中。278.4℃时失全部结晶水。无水硫酸镍为淡黄色晶体。七水合硫酸镍在干燥空气中易风化。溶于水,水溶液呈酸性。能跟碱金属或铵的硫酸盐作用生成水合复盐。用作加氢催化剂、媒染剂、配电镀液。由镍或氧化镍溶于稀硫酸制得。
[硝酸镍]化学式Ni(NO3)2·6H2O,式量290.81。绿色单斜晶体。有潮解性,在干燥空气中微风化。易溶于水,水溶液呈酸性。溶于乙醇。密度2.05克/厘米3,56.7℃熔于结晶水中。沸点136.7℃。有氧化性。用作催化剂,镀镍。由镍溶于稀硝酸制得。
[钌]元素符号Ru,原子序数44,原子量101.1,外围电子排布4d75s1,位于第五周期第Ⅷ族。银白色有金属光泽金属,很硬,冷时延展性小。密度12.30克/厘米3,熔点2310℃,沸点2900℃。第一电离能716千焦/摩尔,电负性2.2。主要氧化数+2、+4、+6、+7、+8。化学性质很稳定。不被普通酸、王水侵蚀,室温下氯水、溴水、碘酒能轻微腐蚀钌。能与熔融的碱、碳酸盐反应。用作铂和钯的硬化剂,钌合金用于电气接触点以及钢笔尖和工具枢轴上。还用作氢化、异构化、氧化和重整的催化剂。1844年俄国人克劳斯从铂矿渣里制得钌。分布极为分散,常与铂、铱、钯、锇共存。从天然铂金属合金中提取。
[铑]元素符号Rh,原子序数45,原子量102.9,外围电子排布4d85s1,位于第五周期第Ⅷ族,第一电离能724千焦/摩尔,电负性2.2。主要氧化数+2、+4、+6。银白色金属,很硬,但有相当的延展性,密度12.41克/厘米3,熔点1966±3℃,沸点3727±100℃。在常温下在空气中稳定保持光亮,加热时形成氧化物(RhO2)保护膜。不跟普通酸和王水反应。在200-600℃时能跟卤素、浓硫酸、氢溴酸、次氯酸钠反应。能和熔融的酸式硫酸盐、碱金属硝酸盐反应。用于制铂铑合金、电热丝、热电偶,用于镀反光镜、宝石的抛光剂、催化剂、电器的接触部件。1803-1804年英国人武拉斯顿在提炼钯铂的废渣中发现了铑。存在于铂矿中。用氢气还原氯化铑制得。
[锇]元素符号Os,原子序数76,原子量190.2,外围电子排布5d66s2,位于第六周期Ⅷ族。蓝灰色金属,六方密堆积晶体。非常硬,密度为 22.57克/厘米3,金属中密度最大。熔点3045±30℃,沸点5027±100℃。原子半径134皮米,第一电离能842千焦/摩尔,电负性2.2。主要氧化数+2、+3、+4、+6、+8。具有硬度高、难熔、耐磨、耐腐蚀的特性。在室温时易形成蓝色氧化膜(OsO2),受热时氧化生成四氧化锇OsO4。能溶于热浓硝酸、浓硫酸。溶于次氯酸钠溶液生成锇酸钠。用来制超高硬度耐磨耐腐蚀的合金、用于仪器枢轴、电器插头、电唱机针,钢笔尖等,还用作催化剂。1803年英国人台奈特从铂矿中发现了锇。存在于锇铱矿中。用氢气还原其硫化物或氢氧化物制得。
[铱]元素符号Ir,原子序数77,原子量192.22,外围电子排布5d76s2,位于第六周期第Ⅷ族。原子半径135.7皮米,第一电离能885千焦/摩尔,电负性2.2,主要氧化数+3、+4、+6。银白色金属,硬度很大,质脆,加热时有良好延展性。密度22.42克/厘米3,熔点2410℃,沸点4130℃。化学性质很稳定,常温下耐腐蚀性很强。不溶于酸、稍溶于王水和熔融碱。1803年由英国人台奈特等发现。纯铱用在飞机火花塞中,还用于制造科学仪器、热电偶、电阻丝、自来水笔尖、耐高温合金、催化剂。国际标准米尺用铂铱合金制成。主要存在于锇铱矿和铂矿中。从分离矿石中制得。
[铂]元素符号Pt,原子序数78,原子量195.09,外围电子排布5d96s1,位于第六周期第Ⅷ族。原子半径138皮米,第一电离能868.4千焦/摩尔,电负性2.2,主要氧化数+2、+4。俗称白金,银白色金属,面心立方体晶体,质柔软,有良好的延展性,密度21.45克/厘米3,熔点1772℃,沸点3827±100℃。化学性质稳定。常温下不锈蚀,不受一般酸碱侵蚀。能溶于王水和熔融碱,还溶于盐酸和过氧化氢、盐酸和高氯酸的混合物中。粉状铂能吸收氢气、氧气和一氧化碳。用作催化剂、热电偶、电极、喷丝嘴、电阻温度计、化学仪器、首饰等。西班牙人乌罗阿和武德分别于1935年和1941 年发现了铂主要以游离态和合金形式存在,主要矿物有铂矿和锇铱矿。极分散。由分离铂矿获得。
[白金]见铂条。
[四氯化铂]化学式PtCl,式量336.9。棕红色晶体,密度4.303克/厘米3。370℃时分解为二氯化铂和氯气。有吸湿性。能溶于水,微溶于乙醇。溶于盐酸生成氯铂(氢)酸。自水溶液中析出时可得到含有5个结晶水的晶体,晶体为红色晶体,密度为2.43克/厘米3。用作分析试剂,催化剂。由氯铂(氢)酸在氯气流中加热而制得。
[氯铂酸]也叫氢氯铂酸,化学式HPtCl6。一般为含六个结晶水的晶体H2PtCl6·6H2O,式量517.92。红棕色晶体,密度2.431克/厘米3,60℃时熔于结晶水。易溶于水、乙醇。灼烧或电解后即得到铂黑。用作化学分析试剂,检验钾、铵等离子。将铂溶于含有过量盐酸的王水中或将四氯化铂溶于盐酸制得。
[铂黑]元素符号Pt,原子量195.05。黑色粉末。在0℃时能吸附大量氢气。不溶于无机酸或有机酸。可溶于王水。用作催化剂,气体吸收剂。灼烧或电解氯铂酸可制得铂黑。
[铂石棉]附有铂的灰黑色石棉纤维。能液于王水。用作催化剂,气体分析中用作氢的吸收剂。将石棉浸入氯铂酸或氯铂酸铵溶液中取出灼烧即得铂石棉。
[钯]元素符号Pd,原子序数46,原子量106.4,外围电子排布4d105s0,位于第五周期第Ⅷ族。原子半径137.6皮米,第一电离能809千焦/摩尔,电负性2.2,主要氧化数+2,+4。银白色金属,柔软,有延展性,密度12.02克/厘米3,熔点1552℃,沸点3140℃。化学性质不活泼。常温下不跟盐酸、硫酸、氢氟酸反应,能被潮湿的氯、溴、碘侵蚀。易与硝酸、王水、三氯化铁、次氯酸盐、以及熔融碱反应。容易吸收氢、氧等气体。室温101.33帕(1大气压下),1体积海绵状钯可吸收800体积左右的氢气。制成合金用于热电偶、电阻器、钟表零件、补牙,还用作加氢、脱氢、异构化和裂变反应的催化剂。1803年英国人武拉斯顿分离粗铂时得到钯。存在于铂矿中。从分离铂矿中获得。
[铜]元素符号Cu,原子序数29,原子量63.55,外围电子排布3d104s1,位于第四周期IB族。原子半径127.8皮米,Cu2+半径72皮米,第一电离能为750千焦/摩尔,电负性1.9,常见氧化数+1、+2。紫红色有光泽的金属,有良好的延展性和传热、导电性。密度8.96克/厘米3,熔点1083.4±0.2℃,沸点2567℃。化学性质不很活泼,在干燥空气中稳定,在含有二氧化碳的潮湿空气中易生成碱式碳酸铜,俗称铜绿(Cu2(OH)2CO3)。加热时跟氧生成氧化铜,跟卤素反应生成卤化铜,加热时跟硫反应生成硫化亚铜。不与水反应。不溶于稀盐酸和稀硫酸。可溶于硝酸和热浓硫酸。也能溶于浓盐酸生成H2CuCl3和H2。缓慢溶于氨水。容易被碱侵蚀。主要用于电器工业,如制电线、电缆、各种电器设备。也用于制各种合金,如黄铜、青铜、白铜等,也用于电镀。古代就发现了铜,主要矿物有黄铜矿(CuFeS2)、辉铜矿(Cu2S)、赤铜矿(Cu2O)、孔雀石(Cu2(OH)2CO3)。铜矿石经冶炼得粗铜,最后经电解精炼得纯铜。
[氧化铜]化学式CuO,式量79.54。黑色立方晶体,密度 6.4克/厘米3,熔点1326℃,不溶于水。溶于稀酸,氰化钾与碳酸铵溶液,缓慢溶于氨水。在1000℃以上分解为氧化亚铜与氧气,加热时易被氢、碳、一氧化碳、氨等还原为铜。可用作制玻璃或瓷器的着色剂(蓝色或绿色)、有机合成的催化剂、油类的脱硫剂,还用于气体分析。由碳酸铜或硝酸铜受热分解制得。
[氢氧化铜]化学式Cu(OH)2,式量97.56。淡蓝色粉末状晶体,密度3.368克/厘米3。难溶于水。受热易分解为氧化铜和水。微显两性,既溶于酸又溶于氨水和浓碱溶液
Cu(OH)2+2NaOH=Na2[Cu(OH)4]
Cu(OH)2+4NH3=[Cu(NH3)4](OH)*
用作媒染剂、颜料、纸张着色。由铜盐溶液和碱溶液反应制得。
[硫酸铜]化学式CuSO4,式量159.6。白色粉末,密度3.608克/厘米3,有强吸水性,吸水后变蓝,生成五水硫酸铜。在650℃时分解为氧化铜和三氧化硫。常见的是五水合硫酸铜蓝色晶体CuSO4·5H2O,俗称胆矾或蓝矾。三斜晶体。晶体中四个水分子以配位键与Cu2+结合,一个水分子以氢键与硫酸根离子结合。易溶于水,在干燥空气中易风化。可用作媒染剂、杀虫剂、杀菌剂、还用于镀铜。由氧化铜跟稀硫酸反应,再经浓缩结晶可制得胆矾。
[胆矾]见硫酸铜条。
[氯化铜]化学式CuCl2,式量134.44。棕黄色粉状结晶。共价化合物。密度 3.386克/厘米3,熔点620℃,993℃分解为氯化亚铜。有毒!易潮解,易溶于水。很浓的溶液显黄绿色,稀溶液显蓝色。黄色是由于[CuCl4]2-络离子存在,蓝色是由于有[Cu(H2O)4]2+的存在,两者共存时显绿色。CuCl2·2H2O为蓝绿色斜方晶体。易潮解,受热分解失去氯化氢生成碱式盐Cu(OH)2·CuCl2。用作化学试剂、氧化剂、媒染剂、木材防腐剂、还用于石油馏分的脱硫、脱臭。由铜跟氯直接化合或由碱式碳酸铜跟盐酸反应制得。
[硝酸铜]常见的是三水合硝酸铜Cu(NO3)2·3H2O,式量241.60。蓝色柱状晶体,密度2.32克/厘米3。易溶于水,易潮解。加热至170℃时失去硝酸生成碱式硝酸铜,加热至200℃分解为氧化铜。有氧化性,与碳、硫等物混和撞击容易爆炸或燃烧。用于镀铜、制农药和搪瓷及染料等。由铜或氧化铜与稀硝酸反应制得。
[碱式碳酸铜]化学式Cu2(OH)2CO3,式量221.11。俗称碳酸铜或铜绿,是铜锈的主要成分。绿色无定形粉末,密度4.0克/厘米3。有毒,不溶于水。在200℃时分解成氧化铜、水和二氧化碳。溶于酸生成铜盐和二氧化碳。用作颜料、杀虫剂、饲料添加剂、磷毒的解毒剂、还用制烟火。由碳酸钠溶液跟硫酸铜溶液反应制得。
[碳酸铜]见碱式碳酸铜条。
[氧化亚铜]化学式Cu2O,式量143.08。由于晶体微粒大小不同,呈现多种颜色,如橙黄、鲜红、深棕色。密度6.0克/厘米3,熔点1235℃。不溶于水。在潮湿空气中易氧化。有毒。溶于稀硫酸,立即发生岐化反应:
Cu2O+H2SO4=Cu2+SO4+H2O
Cu2SO4=CuSO4+Cu
溶于氢卤酸生成无色络合物H[CuX2]。溶于氨水生成无色趼绾衔铮跜u(NH3)2]+,很快被空气中氧气氧化成蓝色的[Cu(NH3)4]2+。用作玻璃或陶瓷的红色颜料,制作整流器材料,有机合成用催化剂,农业用作催化剂。实验室由含酒石酸钾钠的硫酸铜溶液用葡萄糖还原制得。
[硫化铜]化学式CuS,式量95.612。黑色单斜或六方晶体。有金属光泽。密度4.6克/厘米3。熔点103℃(转变),沸点220℃(分解)。难溶于水,不溶于一般稀酸。溶于热的稀硝酸,生成硝酸铜、一氧化氮、硫。溶于氰化钾溶液,生成K3[Cu(CN)4]和(CN)2。有天然矿物,用于提炼铜或制铜化合物。实验室将硫化氢通入硫酸铜溶液制得。
[硫化亚铜]化学式Cu2S,式量159.15。灰黑色有光泽的结晶或粉末。对热稳定。导电性好。不溶于水和稀酸。溶于氨水。跟硝酸反应生成硝酸铜、硫和一氧化氮。熔点1130℃(α型),1100℃(β型)。有毒。用作催化剂。由过量铜跟硫共热制得,或者在硫酸铜溶液中加入硫代硫酸钠溶液共热也可制得。
[孔雀石]化学式Cu2(OH)2CO3或CuCO3·Cu(OH)2。由铜的碱式盐组成。单斜晶系,晶体呈针状,通常为放射状或钟乳状集合体。绿色。有玻璃光泽或金刚光泽,硬度3.5-4;性脆,密度3.9-4.0克/厘米3。产在含铜硫化物矿床的氧化带。块大色美的孔雀石,可琢磨成各种装饰品,粉末用作颜料。遇酸产生二氧化碳并生成铜盐。还用于提炼铜和制备铜盐。
[自然铜]矿物名。化学成分为Cu。等轴晶系。晶体少见,集合体常为不规的则树枝状,鳞片状及粒状。铜红色。富延展性,有良好导电导热性。自然铜为各种地质作用中还原条件下的产物,与赤铜矿,孔雀石矿共生。是一种铜矿石。
[黄铜矿]含铜的主要矿石。化学成分CuFeS2。常以黄铜色块状存在。具有强烈金属光泽。正方晶系。性脆。解理不完全。密度4.1-4.3克/厘米3。硬度3.5-4.0。不溶于水、溶于硝酸。用于炼铜和制备铜化合物。
[黄铜]铜与锌形成的合金。含铜64-67%,含锌33-36%,杂质少于0.3%。有良好可塑性和耐腐蚀性。如还含有一种或几种其它合金元素(如镍、锰、铝、硅等)叫特种黄铜。具有较高的硬度、强度、耐磨性、耐腐蚀性。用于铸造机器零件、制造管材、板材、棒材等,军工用于制枪弹弹壳等。
[青铜]通常指锡青铜。铜、锡为主形成的合金。含铜81-87%,含锡3-4.5%,锌5-7%,铅4-6%。有良好的铸造性能、抗磨性、抗腐蚀性。用于制轴承、阀门、小齿轮、钟表弹簧、热交换器等。此外,铜与铍、铝、锰、硅、磷等组成的二元或多元合金通常称为特种青铜,如铍青铜、磷青铜等。一般有良好的润滑性、高导电性、耐腐蚀性。用于制轴承、齿轮、连杆、仪器零件、板材、管材、棒材以及艺术器等。
[白铜]铜、镍为主形成的合金。含铜78.5-80.5%,镍和钴18-20%。银白色,耐磨性和耐腐蚀性能好。用作医疗器械、精密机械、化工设备零件、日用品等。
[铜绿]铜与含有二氧化碳的潮湿空气接触时,表面生成的绿锈。主要成分是碱式碳酸铜Cu2(OH)2CO3。有毒。易溶于酸和氨水。
[银]元素符号Ag,原子序数47,原子量107.9,外围电子排布4d105s1,位于第五周期IB族。原子半径144.4皮米,Ag半径126皮米,第一电离能735千焦/摩尔,电负性1.9。银白色有光泽金属,柔软,有良好延展性和传热导电性。密度10.5克/厘米3,熔点961.93℃,沸点2213℃。化学性质稳定,不跟氧气和水反应,不与盐酸、稀硫酸和强碱反应。能溶于硝酸或热浓硫酸。在有空气和氧存在时溶于氰化钾溶液,能跟硫或硫化氢反应。在古代就发现了银。银矿主要有辉银矿Ag2S、角银矿AgCl,有自然银。用于制合金、银箔、电路上的接触点、银焊剂、蓄电池、科学仪器、银币、首饰以及用于电镀。由银矿以氰化钠溶液浸出,再加锌使银沉淀出来。
[硝酸银]化学式AgNO3,式量 169.87。无色晶体,密度4.352克/厘米3、熔点212℃,有苦味,易溶于水。444℃时分解成银、二氧化氮和氧气。如有微量的有机物存在或在日光照射下逐渐分解变黑(分解出银、微粒银呈黑色),遇蛋白质变黑色蛋白银。有毒!有腐蚀性,有氧化性。用作照像乳剂、化学试剂、药物、镀银、制镜。将银溶于硝酸,经浓缩、结晶制得。
[溴化银]化学式AgBr,式量187.78。黄色立方晶体。密度6.473克/厘米3,熔点432℃,加热到1300℃以上即可分解。不溶于水、乙醇和酸。溶于氰化钾、硫代硫酸钠溶液,还溶于饱和溴化钾溶液。有感光性,遇光分解,形成极小颗粒银核,含银核的溴化银易被还原剂还原为金属银而呈黑色。用于制摄影胶卷和感光纸。在暗室红光下在硝酸银溶液中加入溴化钾溶液制得。
[氯化银]化学式AgCl,式量143.32。白色立方晶体,熔点455℃,沸点1550℃,难溶于水,溶于氨水、硫代硫酸钠溶液。用于照像、镀银、和医药。在盐酸或食盐水中加入硝酸银溶液制得。
[氧化银]化学式Ag2O,式量231.74。褐色固体,密度7.143克/厘米3,300℃时完全分解生成银和氧气。略溶于水,极易溶于硝酸、氨水、硫代硫酸钠及氰化钾溶液。其氨溶液用完要及时处理,久置会析出强烈爆炸性的黑色晶体--氮化银或亚氨化银。用作氧化剂,玻璃着色剂。由硝酸银溶液跟氢氧化钠溶液反应制得。
[碘化银]化学式AgI,式量234.77。有α黄色立方和β橙色立方两种晶体。α晶体密度5.683克/厘米3,于146℃转化为β型,后者密度为 6.010克/厘米3。熔点558℃,沸点1506℃。见光分解变黑。不溶于水,微溶于氨水,易溶于氰化钾溶液或硫代硫酸钠溶液。用于制照像底片或感光纸,还用于人工降雨。在暗室中或红光下在硝酸银溶液中加入碘化钾溶液,过滤,再用热水洗涤制得。
[硫酸银]化学式Ag2SO4,式量311.8。无色结晶或白色结晶性粉末。密度 5.45克/厘米3,熔点652℃,1085℃时分解。微溶于水。溶于硝酸、氨水和浓硫酸。见光逐渐变黑。用作化学试剂。由硝酸银溶液与硫酸铵溶液反应制得。
[碳酸银]化学式Ag2CO3,式量275.75。新制得的为浅黄色粉末。久置色变暗。感光性很强。不溶于水和醇。溶于氨水、稀硝酸、氰化钾和硫代硫酸钠溶液。用作分析试剂、镀银。
[磷酸银]化学式Ag3PO4,式量418.58。黄色立方晶体。密度6.370克/厘米3,熔点849℃,加热或在日光照射下变为棕色。溶于硝酸、氨水、氰化钾,微溶于水。用于制溴化银、碘化银乳剂。由硝酸银溶液跟磷酸钠溶液反应制得。
[硫化银]化学式Ag2S,式量247.8。黑色立方晶体。不溶于水和氨水。溶于浓硝酸。用于制陶瓷。将硫化氢通入硝酸银溶液可制得。
[金]元素符号Au,原子序数79,原子量197.0,外围电子排布5d106s1,位于第六周期IB族,原子半径144.2皮米,第一电离能895千焦/摩尔,电负性2.4。金黄色有光泽金属,质柔软,富有延展性,1克金可拉成3000米金丝,可锤成只有0.00001毫米厚的半透明金箔。有良好的传热、导电性。密度 18.88克/厘米3,熔点1064.43℃,沸点为3080℃。主要氧化数+1、+3。化学性质很不活泼。在空气中不被氧化,不跟水、酸或强碱溶液反应。能溶于王水生成氯金酸HAuCl4。有氧存在时溶于氰化钾或氰化钠溶液,如:
4Au+8NaCN+2H2O+O2=4Na[Au(CN)2]+4NaOH
跟溴在常温下反应,与氟、氯、碘和碲在高温下反应。古代已发现并应用金。用作晶体管的部件、电接触合金、医药、装饰合金,大部用于货币和工艺品。在地球上分布广而稀少,多以游离态自然金形式存在,也有化合态的如碲金矿AuTe2。主要从岩脉金和冲积金矿提取。
[三氯化金]也称氯化金,化学式AuCl3,式量303.33。紫红色晶体。密度3.9克/厘米3,熔点254℃,沸点265℃(升华)。易潮解。溶于水、乙醇和乙醚中。有氧化性。用于镀金、药物、摄影。将金跟过量氯气共热制得。
[氯金酸]化学式AuCl3·HCl·4H2O,式量411.85。金黄色或橙黄色针状晶体。易潮解。在干燥空气中失去一个水分子。溶于水也溶于乙醇和乙醚。见光出现黑色斑点。有腐蚀性。从乙醇溶液中可结晶出无水氯金酸(三氯化金)。用作分析试剂、铷、铯的微量分析;制备红色玻璃。还用于镀金、照像材料。将金溶于王水,蒸发除去盐酸而制得。
[氢氧化金]化学式Au(OH)3,式量248.02。黄棕色固体,不溶于水。两性氢氧化物。溶于大多数酸;溶于过量强碱溶液,形成络合氢氧金酸盐。微热时分解生成三氧化二金。易还原成金属金。用于镀金、陶瓷着色等。由氯化金溶液跟氢氧化钠溶液反应制得。
[氧化金]别名三氧化二金。化学式Au2O3,式量495.98。棕色粉末,不溶于水。两性氧化物。溶于盐酸和氢氧化钠溶液。见光逐渐分解,160℃时分解成Au2O,250℃时分解为金和氧。用于镀金、瓷器上釉等。将氢氧化金微热可制得。
[锌]元素符号Zn,原子序数30,原子量65.38,外围电子排布3d104s2,位于第四周期ⅡB族。原子半径125皮米,第一电离能915千焦/摩尔,电负性1.6。主要氧化数+2。银白略带蓝色有光泽金属,硬度2.5,有延展性,良好的传热、导电性,密度为7.14克/厘米3,熔点419.58℃,沸点907℃。化学性质比较活泼。室温时在空气中较稳定。在潮湿空气中生成一层灰色碱式碳酸锌,可作保护膜。锌燃烧时有蓝绿色火焰。高温时跟水蒸汽反应放出氢气。加热时可跟卤素,硫等反应。易与酸反应,但高纯锌反应慢,若加入少量硫酸铜溶液,或跟铜、镍、铂等金属接触时,反应加快。溶于强碱溶液,生成锌酸盐,如:
Zn+2NaOH=Na2ZnO2+H2↑
溶于氨水和铵盐溶液中,如:
Zn+2NH4Cl=Zn(NH3)2Cl2+H2↑
主要用于制合金、金属表面镀锌,还用于制于电池、焰火、作催化剂和还原剂。我国明代以前已发现并使用锌。主要矿物有闪锌矿ZnS、菱锌矿ZnCO3等。先将矿石煅烧变成氧化锌,再用焦炭还原氧化锌制得。
[氧化锌]化学式ZnO,式量81.37。俗名锌白。白色六方晶体或粉末。密度5.606克/厘米3,熔点1975℃,难溶于水。加热时变黄,冷却后仍为白色。两性氧化物,溶于酸生成锌盐,溶于强碱溶液生成锌酸盐。还能溶于氯化铵溶液。用作油漆颜料、橡胶填料、制药、粘合剂、釉药、橡皮膏。由锌在空气中燃烧制得。
[硫酸锌]常见的是七水合硫酸锌ZnSO4·7H2O,俗称皓矾,式量287.54。无色晶体,密度 1.957克/厘米3,熔点100℃,易溶于水。280℃时失去结晶水成无水物(白色固体)。600℃时分解成氧化锌。溶于水,水溶液显酸性。用作媒染剂、收敛剂、杀菌剂、木材防腐剂、纸张漂白剂、饲料填加剂、镀锌、治疗缺锌的药剂。由锌与稀硫酸反应制得。
[氯化锌]化学式 ZnCl,式量136.28。白色固体,密度2.91克/厘米3,熔点283℃,沸点732℃。易潮解,易溶于水。高温时浓的氯化锌溶液有溶解金属氧化物的能力。用作媒染剂、有抗合成的脱水剂和催化剂,牙科用作粘合剂,用于饲料添加剂。还用于镀锌、制干电池、石油炼制、焊药水。用盐酸溶解锌或氧化锌制得,经干燥脱水得无水物。
[氢氧化锌]化学式Zn(OH)2,式量99.38。无色斜方晶体。密度3.053克/厘米3,难溶于水。125℃时分解为氧化锌和水。是两性氢氧化物。溶于强酸生成锌盐。溶于强碱生成锌酸盐。和氢氧化铝不同,能溶于氨水中生成锌氨络离子:
Zn(OH)2+4NH3=[Zn(NH3)4]2++20H-
甭缋用作橡胶填加剂、外科药膏。由锌盐溶液加入适量强碱溶液制得。
[锌白]见氧化锌条。
[硫化锌]化学式ZnS,式量97.43。白色或微黄色粉末。α变体为无色六方晶体,密度3.98克/厘米3,熔点1700±28℃(202.66千帕--20大气压);β变体为无色立方晶体,密度4.102克/厘米3,于1020℃转化为α型。不溶于水、易溶于酸。见阳光色变暗。久置潮湿空气中转变为硫酸锌。若在晶体ZnS中加入微量的Cu、Mn、Ag做活化剂,经光照后,能发出不同颜色的荧光。用作分析试剂、涂料、制油漆、白色和不透明玻璃,充填橡胶、塑料,以及用于制备荧光粉。由硫跟锌共热制得。
[磷化锌]化学式Zn3P2,式量258.08。深灰色四方晶体。有恶臭。密度 4.55克/厘米3,熔点高于420℃。干燥时较稳定。在空气中易吸水分解,放出剧毒的磷化氢气体。不溶于醇,可溶于酸。跟水反应可生成磷化氢和联膦P2H4的混和物,这混和物在空气中能自燃。用作杀鼠剂,也可用作海上照明灯。由锌粉跟红磷在500-600℃时反应制得。
[硝酸锌]化学式Zn(NO3)2·6H2O,式量297.47。无色晶体。易潮解,易溶于水和乙醇,水溶液显酸性。36.4℃熔于结晶水。105℃时失去结晶水。有氧化性,与有机物摩擦或撞击能引起燃烧或爆炸。用作分析试剂和制药。将氧化锌溶于硝酸制得。
[锌钡白]俗称立德粉。是硫化锌跟硫酸钡的混合晶体。是一种优良的白色颜料。由硫酸锌溶液跟硫化钡溶液混合制得:
ZnSO4(溶液)+BaS(溶液)=ZnS·BaSO4↓
[皓矾]见硫酸锌条。
[镉]元素符号Cd,原子序数48,原子量112.4,外围电子排布4d105s2,位于第五周期ⅡB族,原子半径141皮米,第一电离能873千焦/摩尔,电负性1.69。微带蓝色的银白色金属,粉末状的呈灰白色。较软,有延展性。密度8.65克/厘米3,熔点320.9℃,沸点765℃,氧化数+2。在空气中迅速生成一层氧化物薄膜并失去光泽,起保护作用。能溶于大多数酸中生成镉盐。用于电镀、轴承,制低熔合金、硬焊合金,制电池、磷光体等。还用于原子反应堆的中子吸收棒。1817年德国人斯特罗迈厄发现了镉。在自然界常与锌伴生,主要矿石是硫镉矿CdS。工业上主要从锌冶炼的副产物中提取。
[硫化镉]化学式CdS,式量144.46。晶体有两种,α-式呈柠檬黄色粉末,β-式呈桔红色粉末。微溶于水,溶于酸,极易溶于氨水。可用于制焰火、玻璃釉、瓷釉、发光材料、颜料。高纯度硫化镉是良好的半导体,对可见光有强烈的光电效应,可用于制光电管、太阳能电池。将硫化氢通入镉盐的酸溶液中制取。
[硝酸镉]化学式Cd(NO3)2·4H2O,式量308.47。白色针状或棱状晶体。密度2.455克/厘米3。59.4℃熔于结晶水。70-80℃时失去结晶水变成无水物,其熔点为350℃。当温度再升高时分解为氧化镉、二氧化氮和氧气。易潮解,溶于水和乙醇,水溶液显酸性。有氧化性。用于瓷器和玻璃着色。用于制备催化剂。由氧化镉、碳酸镉跟硝酸反应制得。
[氯化镉]化学式CdCl3,式量183.32。无色六方晶体。密度4.047克/厘米3,熔点568℃,沸点960℃。易溶于水,微溶于醇。有毒。用作分析试剂,还用于照像、印染、镀镉,制特殊镜子。由氧化镉跟盐酸反应制得。
[硫酸镉]化学式3CdSO4·8H2O,式量769.49。无色单斜晶系柱状结晶。密度3.09克/厘米3、41.5℃失去结晶水。无水物为白色正交晶体,密度4.691克/厘米3,熔点1000℃。易溶于水,不溶于醇。用作分析试剂、催化剂,制造镉锌电池。由镉或氧化镉跟硫酸反应制得。
[汞]元素符号Hg,原子序数80,原子量200.59,外围电子排布5d106s2,位于第六周期ⅡB族。原子半径144皮米,第一电离能1013千焦/摩尔,电负性1.9。俗名水银。常温下唯一以液态存在的金属,银白色,熔点-38.87℃,沸点356.6℃,密度13.59克/厘米3,内聚力很强,在0-200℃间体积膨胀系数很均匀。蒸气有剧毒。在干燥空气中稳定,在潮湿空气中久置表面生氧化物膜。不溶于盐酸、稀硫酸和碱溶液,溶于硝酸和浓硫酸及王水中。能与卤素和硫直接化合。不与水反应。能溶解金、银、铂、铜、铅、钾、钠,所形成溶液称为汞齐。用于制温度计、气压计、催化剂、电极、汞蒸气灯、整流器、药物、雷汞等。古代已经发现。主要矿物有辰砂HgS,也有少量自然汞。将辰砂在空气中焙烧或与生石灰共热得到。
[汞齐]又称汞合金。汞溶解其它金属形成的合金。汞量多时为液态,汞量少时为固体。有广泛用途,如钠汞齐作还原剂、锌汞齐制电池、银汞齐补牙、锡汞齐制镜。
[氧化汞]化学式HgO,式量216.59。俗名三仙丹。有两种变体,红色晶体粉末,黄色晶体粉末。难溶于水。加热至500℃分解为汞和氧气。溶于盐酸生成氯化汞,溶于硝酸生成硝酸汞。有毒。有氧化性。用作氧化剂、分析试剂、医药制剂、陶瓷颜料、制有机汞化合物。在加热至300℃左右由汞和氧化合,或将硝酸汞徐徐加热可得红色氧化汞。将氢氧化钠或碳酸钠跟汞盐溶液反应得黄色氧化汞。
[硝酸汞]化学式Hg(NO3)2·1/2H2O,式量333.61。淡黄色晶体,有毒,密度4.39克/厘米3,熔点79℃。易潮解,易溶于水。有氧化性。徐徐加热生成氧化汞,强热时生成汞、二氧化氮和氧气。用于分析试剂、制药。汞跟硝酸反应制得。
[氯化汞]俗称升汞化学式HgCl,式量271.50。无色晶体。密度5.44克/厘米3,熔点276℃,沸点302℃,溶于水,有剧毒。共价型分子,熔融时不导电。在酸性溶液中有较强的氧化性。水溶液在空气和光的作用下逐渐分解为氯化亚汞、盐酸和氧。有腐蚀性。用作消毒剂、防腐剂、催化剂、医药。将氧化汞溶于盐酸,或将硫酸汞跟氯化钠混和共热制得。
[氯化亚汞]因略带甜味俗称甘汞。化学式为Hg2Cl2,式量472.09。白色正方或四方晶体。密度7.15克/厘米3,熔点303℃,沸点384℃。不溶于水和乙醇。溶于浓硝酸、沸腾的盐酸、氯化铵和碱溶液,生成汞和氯化汞。在光照射下分解生成汞、氯化汞而逐渐变黑。用作杀菌剂、焰火制造,制甘汞电极。由硝酸亚汞溶液跟氯化钠溶液混合制得。
[硫化汞]化学式HgS,式量232.65。有红色六角晶体,有金属光泽,密度 8.10克/厘米3,580℃升华。有黄色单斜晶体,在386℃以上稳定。还有黑色变体(六方晶体或无定形粉末),密闭加热升华得红色变体。难溶于水和醇。溶于硫化钠溶液、硝酸和王水。在空气中加热生成汞和二氧化硫。有毒。用于油画颜料、印泥、油漆、油墨和朱红雕刻漆,还用于医药。天然产的俗称辰砂或朱砂。将汞与硫反应升华制得。
[三仙丹]见氧化汞条。
[升汞]见氯化汞条。
[甘汞]见氯化亚汞条。
[朱砂]天然产的硫化汞俗称,呈红褐色。
[雷汞]又称雷酸汞。化学式Hg(ONC)2,式量284.62。白色或灰色结晶粉末。密度4.2克/厘米3,微溶于冷水,溶于热水和乙醇。有毒。加热或干燥时受轻微振动即爆炸。是常用的炸药起爆药。由硝酸汞在过量硝酸中与乙醇反应制得。
[雷酸汞]见雷汞条。
[钪]元素符号Sc,原子序数21,原子量44.96,外围电子排布3d14s2,位于第四周期ⅢB族。原子半径160.6皮米,第一电离能632千焦/摩尔,电负性1.3,主要氧化数+3。较软的银白色金属,密度2.989克/厘米3,熔点1541℃,沸点2831℃。化学性质活泼,在空气中易被氧化而变暗,跟热水反应放出氢气,跟酸反应放出氢气。用于制备合金和特种玻璃,它的化合物用作催化剂。1876年瑞典人尼尔森发现了钪。主要矿物有钪钇石,常跟钇镧伴生。电解氯化钪可制得钪。
[钇]元素符号Y,原子序数39,原子量88.91,外围电子排布4d15s2,位于第五周期ⅢB族。原子半径181皮米,第一电离能615.6千焦/摩尔,电负性1.2,主要氧化数+3。稀土元素之一。灰色有光泽金属,熔点1522℃,沸点3338℃。与热水反应生成氢氧化物和氢气,也溶于稀酸和氢氧化钾溶液。能吸附氢气。用于制合金、激光器、反应堆的减速剂等。1794年芬兰人加德林发现钇土。用钙还原三氟化钇制得。
[钛]元素符号Ti,原子序数22,原子量47.90,外围电子排布3d24s2,位于第四周期ⅣB族,原子半径144.8皮米,第一电离能 662千焦/摩尔,电负性1.5,主要氧化数+2、+3、+4。银白色有光泽金属,有良好的延展性,密度4.54克/厘米3,熔点1660±10℃,沸点 3287℃。表面易形成致密氧化物保护层,使化学性质变得不活动。加热时,在空气中燃烧生成TiO2。室温时不与水、稀盐酸、稀硫酸和硝酸反应。但能被氢氟酸,熔融碱侵蚀。也能跟热浓盐酸和王水反应。有良好的抗腐蚀性能。钛和钛的合金广泛用于制造飞机、火箭、卫星、宇宙飞船、舰艇、汽轮机、化工设备、电讯器材、人造骨骼等。1791年英国人格列高尔发现钛。在地壳中丰度0.42%,主要矿物有金红石TiO,钛铁矿FeTiO3等。用镁、钠还原四氯化钛制得。
[二氧化钛]俗称钛白或钛白粉。化学式TiO2。式量79.90。白色无定形粉末,加热时变黄色,受高温变棕色,冷时再呈白色。不溶于水。化学性质相当稳定,不溶于盐酸、硝酸和稀硫酸。溶于热浓硫酸、氢氟酸。是弱的两性氧化物,与硫酸氢钾熔融生成硫酸钛;与氢氧化钠熔融生成钛酸钠。用作重要的白色颜料和瓷器釉药,还用于制金属钛、钛铁合金、硬质合金。橡胶、造纸用作填料。电机工业用于制绝缘体、电瓷等。工业上用硫酸分解钛铁矿,除铁后再经水解制得。
[钛白]见二氧化钛条。
[四氯化钛]化学式TiCl4,式量189.91。无色或淡黄色液体,易挥发,密度1.726克/厘米3,熔点-25℃,沸点136.4℃。容易水解,在潮湿空气中发烟
TiCl4+3H2O=H2TiO3+4HCl↑
是制备金属钛的中间产物,在797℃时用熔融镁跟四氯化钛蒸气反应可得海绵状钛。还可用作天然纤维和合成纤维的防水剂。将二氧化钛和碳粉混合加热至800℃左右,用氯处理,可制得:
TiO2+2C+2Cl2=TiCl4+2CO2↑
[锆]元素符号Zr,原子序数40,原子量91.22,外围电子排布4d25s2,位于第五周期ⅣB族。原子半径160皮米,第一电离能664千焦/摩,电负性1.4。浅灰色,硬而脆。密度6.506克/厘米3,熔点1852±2℃,沸点4377℃,主要氧化数+2、+3、+4。常温下不活泼,在空气中形成致密氧化膜保持明亮光泽。耐腐蚀性较好。不溶于盐酸、硝酸及强碱溶液。能溶于王水和氢氟酸。高温时可跟非金属和许多金属反应。金属锆主要用作核反应堆中铀燃料元件的包壳。化学工业用于制耐腐蚀的容器和管道。1789年德国人克拉普罗德发现了锆土。用镁还原四氧化锆制得。
[铪]元素符号Hf,原子序数72,原子量178.49,外围电子排布5d26s2,位于第六周期ⅣB族。原子半径156.4皮米,第一电离能533千焦/摩尔,电负性1.3,主要氧化数+4。银白色有光泽金属。密度13.31克/厘米3,熔点2227℃,沸点4602℃。自然界中与锆伴生,化学性质与锆相似。常温下在空气和水中稳定。不与稀酸和强碱溶液反应。易溶于氢氟酸和王水。对中子有较好的吸收能力。用作核反应堆的控制棒,制X射线管的阴极。1923年德国人科斯特,匈牙利人冯·郝维西由X射线光谱发现。自然界很少。用钠在加热时还原四氯化铪制得。
[钒]元素符号V,原子序数23,原子量50.94,外围电子排布3d34s2,位于第四周期VB族。原子半径132.1皮米,第一电离能654千焦/摩尔,电负性1.6。银白色金属,有良好的延展性。密度 5.96克/厘米3,熔点 1890±10℃,沸点3380℃,主要氧化数+2、+3、+4、+5。常温下化学性质不活动,有较强的耐腐蚀性,不与空气、水反应,也不和非氧化性酸及强碱溶液反应。能溶于氢氟酸、硝酸和王水。高温条件下,钒和氧、氮、碳能反应。主要用于制合金钠和催化剂。1830年瑞典的塞夫斯唐姆发现了钒。主要矿物有钒酸钾铀矿、铅钒矿等。用钙还原五氧化二钒或用镁还原三氯化钒制得。
[五氧化二钒]化学式V2O5。黄色正交晶体。微溶于水,能溶于酸或碱溶液。在有机合成和硫酸工业上用它做催化剂。灼烧钒酸铵制得。
[铌]元素符号Nb,原子序数41,原子量92.91,外围电子排布4d45s1,位于第五周期 V B族。原子半径142.9皮米,第一电离能667千焦/摩尔,电负性1.6,主要氧化数+2、+3、+4、+5。钢灰色有光泽金属。硬而有延展性。密度8.57克/厘米3,熔点2468±10℃,沸点4742℃。室温下在空气中稳定。加热时与卤素反应生成五卤化物。溶于氢氟酸和浓硫酸,能与氢氧化钠溶液反应。主要用于制特种不锈钢、高温合金、超导合金、超级硬质合金。核反应堆中用作铀燃料元件的包壳。 1801年英国人哈契特发现了铌。与钽共存于钽铁矿、铌铁矿中。电解熔融K2NbF7或用活泼金属、碳还原氧化物制得。
[钽]元素符号 Ta,原子序数73,原子量 180.95,外围电子排布5d36s2,位于第六周期VB族。原子半径143皮米,第一电离能745千焦/摩尔,电负性1.5。银白色有光泽金属,有延展性。密度为16.54克/厘米3,熔点2996℃,沸点5425±100℃。化学性质稳定,耐腐蚀性强。除氢氟酸、发烟硫酸及熔碱外,一般不跟水、空气、盐酸、硝酸及王水反应。主要氧化数+5。能吸收氢、氧、氦等气体。用于制造超短波发射器、化学器皿、真空管、化工设备、高速车削工具和催化剂。1802年瑞典人瑞克贝格发现。1903年鲍尔登制得金属钽。主要矿物有铌钽铁矿。电解熔融K2TaF7或用活泼金属、碳还原氧化物制得。
[铬]元素符号Cr,原子序数24,原子量51.996,外围电子排布3d54s1,位于第四周期ⅥB族。原子金属半径124.9皮米,第一电离能657千焦/摩尔,电负性1.6,主要氧化数+2、+3、+6。银白色有光泽金属,含有杂质的铬硬而脆,高纯铬有延展性。耐腐蚀性强,不溶于水,在空气中即便是在高温下氧化也很缓慢。高温下,铬能与卤素、硫、氮、碳等化合,也能跟水蒸气反应。能慢慢地溶于稀盐酸、稀硫酸、生成二价铬盐(蓝色),与空气接触时很快被氧化成三价铬盐(绿色)。铬能与浓硫酸反应,但不溶于浓硝酸,因表面生成致密氧化膜而呈钝态。能被熔融碱侵蚀。与氢反应生成CrH2。主要用于制不锈钢及耐高温耐腐蚀的高强度的合金,制电阻合金,还用于电镀。1797年法国人沃克兰发现了铬。主要矿物有铬铁矿Fe(CrO2)2。由电解铬氨钒溶液或铬酸溶液制得,也可用铝粉还原氧化铬制得。
[三氧化二铬]亦称氧化铬。化学式Cr2O3,式量151.99。绿色六方晶体或无定形粉末。密度5.21克/厘米3,熔点2266±25℃,沸点4000℃。不溶于水,不溶于碱溶液,略溶于酸。具有磁性。用作分析试剂、催化剂、陶瓷釉彩原料、油漆颜料、制备铬合金和铬盐。实验室由重铬酸铵(NH4)2Cr2O7受热分解制得
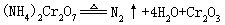
[三氧化铬]亦称铬酸酐。化学式CrO3,式量99.99。红色正交晶体,常呈针状或柱状结晶。密度2.7克/厘米3,熔点196℃。易潮解,易溶于水,水溶液是铬酸。溶于醇、硝酸或硫酸。有强氧化性。有毒、有腐蚀性。用作分析试剂、强氧化剂,还用于镀铬、制铬酸盐、玻璃着色。由重铬酸钠与浓硫酸共热制得。
[铬酐]铬酸酐的简称,见三氧化铬条。
[氯化铬]别名三氯化铬。化学式CrCl3,式量158.38。无水氯化铬为强烈发光的紫色六角晶系的片状结晶。密度2.9克/厘米3,熔点1150℃。几乎不溶于水,与水长时间沸腾可形成绿色溶液。在空气中灼烧可变为三氧化三铬。六水合氯化铬CrCl3·6H2O有三种变体,分别呈深绿色、浅绿色和紫色。水合物易潮解,易溶于水。用作媒染剂、催化剂、无机合成。将三氧化二铬溶解在浓盐酸中,结晶可制得六水合氯化铬。
[钼]元素符号Mo,原子序数42,原子量95.94,外围电子排布4d55s1,位于五周期ⅥB族。原子半径136.2皮米,第一电离能689千焦/摩尔,电负性1.8。主要氧化数+2、+3、+4、+5、+6。银灰色有光泽的金属。质硬而有延展性。密度10.22克/厘米3,熔点2610℃,沸点5560℃,在很高的温度下仍有很高的强度。常温时在空气中稳定,高温时燃烧生成三氧化钼。跟氯和溴能化合。不溶于盐酸和氢氟酸。能溶于浓硫酸、硝酸和王水。纯钼丝用于高温电炉,纯钼片用于制电子管、晶体管和X射线器材、灯泡。合金钢加钼可提高弹性、抗腐蚀性,保持永久磁性。1782年瑞典埃易姆用碳还原钼酸得到钼。主要矿物有辉钼矿MoS2,钼钨钙矿。用氢或铝还原三氧化钼制得。
[三氧化钼]化学式MoO3,式量143.94。白色透明斜方晶体,加热时转为黄色,冷却后恢复原来颜色。密度4.692克/厘米3,熔点795℃,沸点1155℃,易升华。不溶于水,可熔于氨水和强碱溶液,生成钼酸盐。溶于强酸、生成二氧钼根(MoO22+)和氧钼根(MoO4+)络合阳离子,与酸根可形成可溶性络合物。氧化性极弱,在高温下可被氢、碳、铝还原。用作分析试剂,制备钼合金和钼盐。在空气中灼烧钼或二硫化钼或者焙烧钼酸制得。
[钨]元素符号W,原子序数74,原子量183.85,外围电子排布5d46s2,位于第六周期ⅥB族。原子半径137皮米,第一电离能775千焦/摩尔。电负性1.7,主要氧化数+2、+3、+4、+5、+6。银灰色有光泽金属,硬度很大,密度19.3克/厘米3,熔点3410±20℃,沸点 5660℃。化学性质很稳定,常温时不跟空气和水反应,不溶于盐酸、硫酸、硝酸和碱溶液。溶于王水以及硝酸和氢氟酸的混合液。高温下能与氯、溴、碘、碳、氮、硫等化合,但不与氢化合。用于制钨丝、电学仪器、光学仪器、高速切削钢、特种钢、X射线靶等。1783年西班牙人德普尔亚发现钨。重要钨矿有钨锰铁矿(FeMn)WO4,钨锰矿MnWO4等。处理钨矿石得三氧化钨。再用氢还原三氧化钨制得钨粉。
[三氧化钨]化学式WO3,式量231.85。黄色正交结晶或橙黄色粉末。密度7.16克/厘米3,熔点1473℃。不溶于水和一般无机酸。溶于氢氟酸和浓碱溶液。高温下可被氢、碳、铝等还原。用于制金属钨和钨合金,还用于制钨盐、釉彩、防火织物、X射线用屏。将钨在氧气中燃烧或将钨酸脱水可制得。
[钨酸]化学式H2WO4,式量249.88。黄色或黄绿色粉末。密度5.5克/厘米3,熔点100℃(失水)。不溶于水,不溶于一般酸。溶于氢氟酸,溶于氢氧化钠溶液。用于制钨、钨丝,还用作纺织品的媒染剂。在钨酸钠热溶液中加入强酸即可析出黄色的钨酸。
[锰]元素符号Mn,原子序数25,原子量54.94,外围电子排布3d54s2,位于第四周期ⅦB族。原子半径124皮米,第一电离能727千焦/摩尔,电负性1.5。主要氧化数+2、+4、+6、+7。银白色金属,硬而脆,密度7.20克/厘米3,熔点1244+3℃,沸点1962℃。固态时有四种同素异形体,常温下为α锰。在空气中易氧化生成褐色氧化物覆盖层。燃烧时生成四氧化三锰。红热时与水反应生成四氧化三锰和氢。溶于稀盐酸、稀硫酸生成二价锰盐。高温时跟卤素、硫、磷、碳、氮直接化合。用于制合金,少量锰能改善钢的抗冲击性能,锰铁用作炼钢过程的脱氧、脱硫添加剂。还用于冶炼铝合金、镁合金。1774年瑞典人甘恩用木炭跟软锰矿共热得到锰。主要矿物有软锰矿MnO2·xH2O、黑锰矿Mn3O4,最近发现大洋底部有大量锰结核矿。在地壳中丰度为0.1%。用铝还原软锰矿制得。
[二氧化锰]化学式MnO2,式量86.94。钢灰色块状固体或黑色粉末。天然产的称软锰矿。密度5.026克/厘米3。不溶于水。溶于浓盐酸生成MnCl2和Cl2。在浓硫酸中放出氧气并生成硫酸锰。与氯酸钾、氢氧化钾共熔生成锰酸钾。在酸性介质中呈强氧化性。用作催化剂,氧化剂,制干电池,还用于炼钢、制玻璃、陶瓷、热敏电阻。将硝酸亚锰加热到200℃制得。也可从天然软锰矿制取。
[硫酸锰]化学式MnSO4·4H2O,式量223.08。微红色细小晶体。密度2.107克/厘米3。在干燥空气中风化。280℃失去结晶水成白色无水物。溶于水。用于制锰肥、电解锰、油漆催干剂。由二氧化锰跟硫酸反应制得。
[锝]元素符号Tc,原子序数43、原子量98.9,外围电子排市4d55s2位于第五周期ⅦB族。原子半径135.8皮米,第一电离能708千焦/摩尔,电负性1.9,主要氧化数+4、+7。银灰色金属,密度11.50克/厘米3,熔点2200℃,沸点4877℃。是第一个用人工方法得到的元素,它的同位素都有放射性,97Tc最稳定,半衰期为2.6×106年。化学性质与铼相似。高温与氧反应生成Tc2O7,不溶于稀硫酸、盐酸,溶于硝酸生高锝酸,溶于王水。1937年美国人佩里厄和塞格瑞在回旋加速器里用氘核轰击钼-98制得。在自然界中的铀裂变产物中有锝的同位素。用于原子能工业。主要由人工核反应制得。
[铼]元素符号Re,原子序数75,原子量186.2,外围电子排布5d56s2,位于第6周期ⅦB族。原子半径137皮米,第一电离能765千焦/摩尔,电负性1.9,主要氧化数+3、+4、+7。银白色有光泽金属,质软,有良好延展性,电阻大。密度21.04克/厘米3,熔点3180℃,沸点5627℃。327℃时被氧化生成Re2O7。高温时能与氟,氯、溴、硫反应。不溶于盐酸、稀硫酸。可溶于硝酸或过氧化氢溶液生成高铼酸HReO4。可吸收氢。用于制耐热、耐腐蚀合金,这些合金用于制卫星和火箭的外壳。用于制高温热电偶、特种灯丝、有机合成工业的催化剂。地壳中丰度10-7%,主要存于辉钼矿中。1925年由德国人诺达克、塔克和贝格发现。用氢还原铼的化合物制得。
[镧]元素符号La,原子序数57,原子量138.9,外围电子排布5d16s2,位于第六周期ⅢB族。原子半径187.7皮米,电负性1.1,主要氧化数+3。银白色金属,柔软,有延展性,密度6.145克/厘米3,熔点921℃,沸点3457℃。化学性质活泼与铝相似。在空气中易被氧化成白色粉末La2O3,燃烧时生成氧化物和氮化物。在氢气中加热生成氢化物。与水反应生成氢氧化镧和氢气。易溶于稀酸生成镧盐和氢气。应保存在煤油中。用来制镧盐、不锈钢、引火合金、医药、高级光学玻璃、超导体。1839年瑞典人莫桑德尔发现了镧,第一个稀土元素。在地壳中丰度0.0018%。在稀土元素中居第二位。常与其它稀土元素共生于独居石或氟碳锶镧矿中。用钠还原无水氯化镧,或电解熔融无水氯化镧制得。
[铈]元素符号Ce,原子序数58,原子量140.12,外围电子排布4f15d16s2,位于第六周期ⅢB族。原子半径182.5皮米,电负性1.1,主要氧化数+3、+4。灰色金属,有延展性,密度:立方晶体6.76克/厘米3,六方晶体6.66克/厘米3,熔点799℃,沸点3426℃。化学性质活泼。在干燥空气中稳定,在潮湿空气中表面易氧化,加热时燃烧生成二氧化铈。能跟氢、氯、溴、碘、硫直接化合。能与沸水反应,溶于酸,不溶于碱。铈的着火点很低(165℃)燃烧时放大量热。以铈为主的轻稀金属混合物,在摩擦或撞击时、其细末可自燃。用于制打火石和军用引火合金,还可用作催化剂、冶金时的吸气剂、玻璃工业的着色剂、抛光剂、电弧电极、特种玻璃、煤气灯纱罩。1803年德国人克拉普罗特、瑞典人贝采利乌斯和息辛格分别发现了铈。是稀土元素中最丰富的,在地壳中的丰度为0.004%,主要矿物有独居石、氟碳铈矿。用镁粉还原氧化铈,或电解熔融氯化铈制得。
[镨]无素符号Pr,原子序数59,原子量140.9,外围电子排布4f36s2,位于第六周期ⅢB族。原子半径182.8皮米,电负性1.1,主要氧化数+3、+4。银灰色金属。有两种晶体。α六方晶体熔点为931℃,沸点为3512℃,密度为6.77克/厘米3;β型立方晶体熔点为935℃,沸点为3127℃,密度为6.64克/厘米3。化学性质活泼,在潮湿空气中易氧化生成氧化物膜。与水反应放出氢生成氢氧化物。易溶于盐酸、稀硫酸和硝酸。用于制合金、催化剂、特种玻璃、颜料、陶瓷着色。1885年由冯·威尔塞巴赫发现。主要存在于独居石矿中。电解熔融无水氯化镨制得。
[钕]
[氦]元素符号He,原子序数2,原子量4.0026,外围电子排布1s2,位于第一周期0族。单质由单原子分子组成,是一种稀有气体,无色、无臭、无味。密度0.17847克/升,是氢以外密度最小的气体。熔点-272.2℃,沸点-268.9℃。临界温度-267.9℃,临界压力227.98帕(2.25大气压)。是最难液化的气体。20℃时每升水中仅能溶13.8毫升气体,是最难溶于水的气体。原子范氏半径122皮米。第一电离能2372千焦/摩尔,是化学性质最不活泼的元素。不燃烧,不支持燃烧,基本上不与任何物质发生化学反应。用于充填探空气球、气艇、电子管;在焊接或冶炼金属时用做保护气。用液氦取得低温,广泛应用于超导设备、粒子加速器等尖端技术中。用氦、氧混和气(人造空气)供深水潜水员呼吸可防潜水病。液氦可制低温温度计。还用于制激光器及霓虹灯。1868年德国天文学家简孙用分光镜发现太阳光谱中有一条新的谱线,后经英天文学家洛克耶尔据此断定太阳上有一种当时地球上尚未发现的元素,命名为氦,拉丁文原意是“太阳”。地球上的氦是放射性元素的衰变产物,放射出来的α粒子(即氦原子核或氦离子)在空气中获得两个电子成为氦原子。在空气中氦约占体积的5×10-4%,天燃气中含有较多的氦。可由液体空气中分馏氦氖混和气中提取,也可以分馏含氦天然气(液态)获得。
[氖]元素符号Ne,原子序数10、原子量20.183,外围电子排布2s22p6,位于第二周期第0族。原子范氏半径160皮米,第一电离能2038千焦/摩尔。单质由单原子分子组成,是一种稀有气体。无色、无嗅、无味,气体密度0.9002克/升,液体密度为1.204克/厘米3,熔点-248.67℃,沸点-245.9℃。化学性质极不活泼,不能燃烧,也不支持燃烧,一般情况下不能生成化合物。0℃时在每升水中溶解14.7毫升。在低压放电时被激发出亮桔红色光。用于制霓虹灯、激光器、指示灯,还用于高能物理研究。液态氖可用作冷冻剂。在1898年英国人拉姆塞,特拉威斯从分析气体的光谱中发现了氖,拉丁文是“新”的意思。在大气中含量为18.18ppm(体积)。分离液体空气得到氦氖混和气,再用活性炭选择吸附法或经液氢冷却法分离出氖。
[氩]元素符号Ar,原子序数18,原子量39.948,外围电子排布3s23p6,位于第三周期0族。原子范氏半径191皮米,第一电离能1523千焦/摩尔。单质由单原子分子组成,是一种稀有气体。无色、无嗅、无味气体,密度117837克/升,熔点-189.2℃,沸点-185.7℃,20℃时每升水中可溶解37.9毫升。化学性质极不活泼,不燃烧,不支持燃烧,不能生成化合物。可跟水、苯酚、氢醌等形成一些包合物。用于充填电灯泡和日光灯管,切割或焊接金属时用作保护气体。用少量氖与其混合可制成蓝色或绿色放电管。在稀有气体中是含量最多的一种,在大气中约占体积的0.94%。1894年英国人瑞利从空气中除去氧、氮后的剩余的气体进行光谱分析,发现了氩。工业上用分馏液体空气得到氩。
[氪]元素符号Kr,原子序数36,原子量83.80,外围电子排布4s24p6,位于第六周期0族。单质由单原子分子组成,稀有气体,无色、无嗅、无味。密度3.733克/升,熔点-156.6℃,沸点为-153.3±0.1℃。原子范氏半径198皮米,第一电离能1351千焦/摩尔。20℃时每升水可溶解23毫升。化学性质极不活动,已制得在-80℃时才稳定的化合物氟化氪KrF2。用于充填电灯泡和电子器件。能吸收X射线,用作X射线工作时的遮光材料。它跟氩混合可充填霓虹灯管。还用于充填电离室以测量宇宙射线。1898年美国人拉姆塞和特拉威斯从蒸发液体空气的残余物中经光谱分析发现了氪。在大气中含1.1×10-4%(体积)的氪。工业上用分馏液体空气制得。
[氙]元素符号Xe,原子序数54,原子量131.30,外围电子排布5s25p6,位于第五周期0族,原子共价半径209皮米,第一电离能1172千焦/摩尔。单质由单原子分子组成。稀有气体、无色、无嗅、无味,密度5.887克/升,熔点-111.9℃,沸点-107.1±3℃,20℃时每升水中可溶解110.9毫升(体积)。能吸收X射线。化学性质不活泼。能跟水,氢醌、苯酚等形成弱键包合物,在加热或紫外线照射、放电条件下,氙可跟氟直接化合生成XeF2、XeF4、XeF6等氟化物,XeF4和XeF6强烈水解可得到XeO6或XeOF4等。在电场作用下能发出强烈的白光。用于制高压长弧氙灯(俗称人造小太阳),产生紫外线的高压电弧灯、闪光灯、中子计数器,X射线计数器,还用作麻醉剂、原子反应堆中的中子吸收剂、充填闸流管和探测宇宙线用的电离室。1898年英国人拉姆塞和特拉威斯在分馏液态氪的混合物时,通过光谱分析发现了氙。在空气中含有9×10-6%(体积)。工业上用分馏液体空气提取。
[氡]元素符号Rn,原子序数86,原子量222.02,外围电子排布6s26p6,位于第六周期0族。原子共价半径214pm,第一电离能1038千焦/摩尔。单质由单原子分子组成,稀有气体,有放射性,衰变时释放出高能量的α粒子,寿命最长的同位素222Rn的半衰期为3.82天。无色气体,密度9.73克/升,熔点-71℃,沸点-61.8℃。溶于水并能使水分解。能被活性炭、硅胶吸附,加热时又可解吸。化学性质很不活泼,已制成的化合物有氟化氡。用于放射治疗或作中子源。1900年德国人多尔恩在铀制品中发现。在地壳中的丰度为6.0×10-16%。
[稀有气体]又称惰性气体,指周期系零族元素,包括氦、氖、氩、氪、氙、氡六种元素。这些气体存在于大气中但含量很低。
[氟]元素符号F,原子序数9,原子量18.99。外围电子排布2s22p5,主要氧化数-1,0。位于第二周期第ⅦA族。原子半径64皮米,F-半径133皮米,第一电离能1682千焦/摩尔,电负4.0。单质氟由双原子分子F2组成。淡黄色气体,有令人不快的气味。密度1.696克/升(标准状况),熔点-219.6℃,沸点-188.14℃。离解能154.8千焦/摩尔。氟是电负性最大,非金属性、氧化性最强的元素,化学性质非常活泼。有毒。能跟绝大多数元素化合生成二元氟化物,放出大量热,发生燃烧。跟铝、镍、镁、铜反应时常形成致密的氟化物保护膜。跟水发生剧烈反应,生成物主要有氟化氢和氧气,以及少量的过氧化氢、二氟化氧和臭氧。可从化合物中置换其它非金属元素,如氟气可从固态卤化物中置换出氯、溴、碘。与稀碱溶液反应放出OF2
2F2+2NaOH=2NaF+OF2↑+H2O
在加压、加热条件下氟能跟氙直接化合,生成二氟化氙、四氟化氙和六氟化氙。大量氟用来氟化有机物,如氟里昂--12CCl2F2广泛用作致冷剂,CBr2F2用作高效灭火剂,CCl3F用作杀虫剂。称为特氟隆的聚四氟乙烯具有高弹性、低介电常数、低摩擦系数、耐热抗腐蚀等优良性能,用于制电工、化工器材。原子能工业制UF6,用扩散法分离出235U。1886年法国的莫瓦桑,在铂制U形管中,以铂铱合金作电极,电解氟氢化钾的无水氟化氢熔液得到氟。氟在地壳中的丰度为0.066%,主要以化合态存在,主要矿物有萤石CaF2,冰晶石Na3AlF6和磷灰石Ca5F(PO4)3。工业上以石墨和铁作电极,电解熔融的氟氢化钾和氟化氢的混和物制得,电解总反应为:
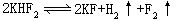
[氟化氢]化学式HF,式量20.01。无色有刺激臭味气体或液体,极性分子,由于很强的氢键作用,常温下气体呈(HF)n(n=2-6)的缔合形式存在,80℃以上才基本由HF组成。液态时可能以比较稳定的五分子环(HF)5或六分子环(HF)6状态存在。气体密度0.991克/升,液体密度0.987克/厘米3,沸点19.54℃,熔点-83.1℃,有很强的腐蚀性和毒性。在空气中易形成白色酸雾,易溶于水,水溶液叫氢氟酸,酸性较弱。能溶于乙醇。能腐蚀玻璃。氟化氢是一个介电常数大的液体,能自行电离,并能与许多溶质形成导电溶液,可溶解许多有机化合物。无水液态氟化氢是一种很强的酸。应保存在塑料容器中。用于制氟化物、氢氟酸、氟硼酸、氟硅酸、有机氟碳化合物,含氟冷冻剂、含氟树脂,还用作半导体材料的清洗剂,蚀刻玻璃等。用浓硫酸跟氟化钙反应制得。
[氢氟酸]化学式HF,式量20.01。即氟化氢的水溶液。无色有刺激性气味。有强烈腐蚀性和毒性。浓度不高时酸性弱(室温下K=3.5×10-4),这是因为分子间易形成氢键,难电离出氢离子。浓溶液(5-15摩尔/升)酸性增强变成强酸,因为一部分F-通过氢键与HF形成缔合离子,如:
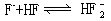
消耗了溶液中的F-,而使HF的电离度增大。能跟二氧化硅或硅酸盐反应生易挥发的SiF4,故易于腐蚀石英、玻璃及其它含硅物质。市售氢氟酸含氟化氢50%。用于制备高纯氟化物,刻蚀玻璃、镀件表面处理、酸洗铜、黄铜、不锈钢等。用水吸收氟化氢制得。
[氯]元素符号Cl,原子序数17,原子量35.453,外围电子排布3s23p5,位于第三周期3ⅦA族。原子半径99皮米,Cl-半径181皮米,第一电离能1251千焦/摩尔,电负性3.0,主要氧化数-1、0、+1、+3、+5、+7。单质氯以双原子分子Cl2组成。黄绿色有刺激性臭味的气体,有毒。密度 3.214克/升,熔点-100.98℃,沸点-34.6℃,离解能246.7千焦/摩尔。液态氯为金黄色液体,固态氯为四方晶体。20℃时在水中溶解度为7.29克/升,氯的水溶液呈黄绿色。部分水解成盐酸、次氯酸HClO,后者有漂白性。易溶于二硫化碳、四氯化碳等有机溶剂。在低温下干燥氯气化性不十分活泼。有痕量水存在时,活泼性急剧增加。能跟所有金属化合,能跟氧、氮、碳以外非余属单质直接化合。生成氯化物。有强氧化性,是强氧化剂。跟碱反应生成盐酸盐和次氯酸盐,如:
Cl2+2NaOH=NaCl+NaClO+H2O
加热时跟碱反应生成盐酸盐和氯酸盐,如:
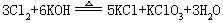
跟饱和烃发生取代反应,跟不饱和烃发生加成反应。用于制漂白粉、盐酸、盐酸盐、农药、塑料、有机溶剂、染料、化学试剂,还用于漂白纸浆、布匹、饮水消毒、稀有金属和纯硅的提炼。1774年瑞典人舍勒用盐酸跟二氧化锰反应制得氯气,但不知道它是什么。1810年英国人戴维确定氯气是一种单质,确定了氯元素的存在。氯主要以氯化钠的形式存在于海水、盐湖和岩盐矿中。由35Cl和37Cl两种稳定同位素组成。在地壳中的丰度为0.14%。工业上用电解饱和食盐水制得,实验室常用浓盐酸跟二氧化锰共热制备。
[氯化氢]化学式HCl,式量36.46,无色有刺激性气味的气体。密度1.6394g/L,液态无色,密度1.187克/厘米3。熔点-114.8℃,沸点-84.9℃。易与空气中水蒸气形成白色酸雾,易溶于水,1体积水可溶500体积氯化氢(标准状况),水溶液称盐酸。也溶于乙醇和乙醚。干燥氯化氢化学性质不活泼,很难分解,对锌,铁等金属无作用;遇氨冒白烟,生成氯化铵。用于制盐酸、氯化物、氯乙烯,还用于聚合、异构、烷基化等反应,以及作缩合剂、催化剂等。工业上用氢气跟氯气合成。实验室由浓硫酸跟食盐共热制得。
[盐酸]化学式HCl,式量36.46。又称氢氯酸。是氯化氢的水溶液。市售浓盐酸含HCl37-38%,密度1.19克/厘米3,约12摩尔/升。含氯化氢20.22%的盐酸恒沸点为108.58℃。无色液体,易挥发,有刺激性臭味,有腐蚀性。强酸。能跟许多金属反应放出氢气并生成相应的氯化物。能和多种金属氧化物,碱反应生成盐酸盐和水。是重要的化工原料。广泛用于化学工业、冶金工业、石油工业、食品工业、制药工业。在电镀、焊接时用于清洗金属表面。稀盐酸用于治疗胃酸缺乏症。用水吸收氯化氢制得。
[氯酸]化学式HClO3,正五价氯的含氧酸仅仅存在于溶液中,呈无色,水溶液在真空中可浓缩到密度为1.282克/厘米3。不稳定,加热到40℃即被分解,并爆炸。有强酸性、强氧化性。用作化学试剂。由氯酸钡溶液跟硫酸反应后,经过滤、浓缩制得。
[次氯酸]化学式HClO,正一价氯的含氧酸,仅存于溶液中。稀溶液无色,浓溶液呈黄色,有强刺鼻气味。是一种弱酸K=3.0×10-8,极不稳定,见光分解为盐酸和氧气。有氧化性和漂白性,有杀菌能力。将氯气的水溶液中加入氧化汞或碳酸钙。再经减压蒸馏可得低于5%的次氯酸溶液。将一氧化二氯Cl2O与水反应可得高于5摩尔/升的次氯酸。
[高氯酸]化学式HClO4,式量100.46,最高价氯的含氧酸。无色粘稠液体,密度1.76克/厘米3,熔点-112℃,沸点39℃(7459帕--56毫米汞柱)。易吸湿,溶于水,常用试剂浓度为70%。纯态不稳定。已知最强酸,能与活泼金属反应放出氢气,与氨反应生成铵盐。有强氧化性,遇有机物发生爆炸性反应,同HI或SOCl2反应时会燃烧。纯酸加热至90℃分解为ClO2及O2。冷的稀溶液稳定性高。不显氧化性。有腐蚀性。用于制炸药、医药、分析化学。用高氯酸钾同浓硫酸反应后,再经减压蒸馏制得。工业上用铂电极电解氧化盐酸制得。
[王水]一体积浓硝酸与三体积浓盐酸的混合液(其摩尔比为1:3)。无色液体,但迅速变黄。具有比浓硝酸或浓盐酸更强烈的腐蚀性,能溶解铂和金。王水中含有硝酸、氯化亚硝基、氯等强氧化剂。
HNO3+3HCl=NOCl+Cl2+2H2O
王水中也含有高浓度的氯离子,能跟金属离子形成稳定的络离子,有利于向金、铂溶解方向进行
Au+HNO3+3HCl=AuCl3+NO+2H2O
AuCl3+HCl=H[AuCl4]
3Pc+4HNO3+12HCl=3PtCl4+4NO+8H2O
PtCl4+2HCl=H2[PtCl6]
冶金工业和化学分析用于溶解金属。
[溴]元素符号Br,原子序数35,原子量79.909,外围电子排布4s24p5,位于第四周期第ⅦA族。原子半径114皮米,Br-半径196皮米,第一电离能1141千焦/摩尔,电负性2.8。主要氧化数-1、+1、+3、+5、+7。溴单质由双原子分子Br2组成。棕红色易挥发有强烈刺激性臭味的液体。密度3.119克/厘米3,熔点-7.2℃,沸点58.76℃。有毒,有腐蚀性。蒸气呈棕红色,固态呈黄绿色有金属光泽。20℃时在水中的溶解度为3.38克/100克水,易溶于四氯化碳,二硫化碳、乙醇等有机溶剂中。化学性质和氯相似,能与氢、金属和多数非金属反应,只是活泼性比氯差。用于制溴化物、药物、染料、熏蒸剂、灭火剂;还用于漂白、消毒。1826年,法国人巴拉尔得把氯气通入盐湖的提盐后的废母液中制得溴,并确定它是一种元素。自然界中主要以氢溴酸盐的形式存在。在地壳中的丰度为2.5×10-4%。工业上从海水制溴,即将氯气通入盐卤中把溴置换出来。
[溴化氢]化学式HBr,式量80.92。无色有刺激性气味的气体,密度3.5克/升,在空气中形成白色酸雾。易溶于水,水溶液叫氢溴酸。熔点-88.5℃,沸点-67.0℃。用于药物合成,并用作烷化催化剂。由氢与溴直接化合,或由溴化钠与磷酸或70%硫酸反应制得。
[氢溴酸]化学式HBr,式量80.92。氢溴酸是溴化氢的水溶液。无色,有刺激性的酸味,酸性强。有强腐蚀性。有还原性。用于医药、化学分析和有机合成。将溴化氢通入冷水中制得。
[溴酸]化学式HBrO3,式量128.92。仅存于溶液中。在100℃分解。是氧化性强的强酸。用作氧化剂,制染料、制医药。由溴酸钡与硫酸反应,再经蒸馏溶于水制得。
[碘]元素符号I,原子序数53,原子量126.9,外围电子排布5s2p5,位于第五周期ⅦA族,原子半径133皮米,I-半径220皮米,第一电离能1008千焦/摩尔,电负性2.5,主要氧化数-1、+1、+3、+5、+7。单质由双原子分子组成。紫黑色晶体,密度4.93克/厘米3,熔点113.5℃,沸点为184.35℃。有金属光泽,易升华,性脆。有毒性和腐蚀性。微溶于水,溶液呈褐色,由于歧化反应,显酸性。易溶于乙醇、二硫化碳、四氯化碳等有机溶剂。也易溶于碘化钾溶液,形成KI3,溶液呈深褐色。遇淀粉变蓝色。能与氟、氯、溴、磷、氢、多数金属直接化合,但不如其它卤素化学性质活泼。用于制感光材料、医药、染料、碘化合物等。1817年法国人库尔特瓦斯用硫酸处理海藻灰时发现了碘,希腊文原意是紫。碘在地壳中的丰度为3.0×10-5%,自然界海藻,石油矿井水及智利硝石中含有较多的碘。自然界中的碘主要以NaIO3形式存在,可用亚硫酸氢钠还原制取:
2IO-3+5HSO-3=5SO24-+H2O+3H++I2
实验室中用碘化物与二氧化锰和浓硫酸混合制取:
2NaI+3H2SO4+MnO2=2NaHSO4+MnSO4+2H2O+I2
[碘化氢]化学式HI,式量127.91。无色有刺激性气体。密度5.66克/升,熔点-50.8℃,沸点-35.38℃。易液化,液体呈苍黄色。在空气中与水蒸气形成白色酸雾,极易溶于水并放出大量热,其水溶液称氢碘酸,是强酸。碘化氢很不稳定,300℃时,即分解为碘和氢。有强还原性,可被Cl2、Br2、浓硫酸氧化游离出碘。用作还原剂、消毒剂、分析试剂、制备碘盐、合成药物。由碘蒸气跟氢气在铂催化条件下合成或由三碘化磷水解制得。
[氢碘酸]化学式HI,式量127.91。氢碘酸是碘化氢的水溶液。无色液体。饱和溶液在0℃时含90%的碘化氢。是一种强酸。有强腐蚀性和强还原性。常温下能被空气中氧氧化而析出碘,使溶液变淡黄色或棕色,在光的照射下反应更快。可用于制碘化物,药物、染料、香料、消毒剂,有机碘化合物。
[碘酸]化学式HIO3,式量175.91。无色正交晶体,密度4.629克/厘米3,熔点110℃,加热到110℃时,开始转变为HI3O8。195℃时完全脱水而成五氧化二碘I2O5。加热到300℃以上才分解为碘和氧气。是强酸,浓溶液有强氧化性。用作化学试剂、强氧化剂、制药物。用强氧化剂如Cl2、O3、HNO3、H2O2等氧化碘可制得纯碘酸,如:
I2+10HNO3(浓)=2HIO3+10NO2↑+4H2O
[砹]元素符号At,原子序数85,原子量210(最稳定的同位素的质量数),外围电子排布6s26p5,位于第六周期第ⅦA族。是极不稳定的元素,约有25种同位素,都有放射性,其中最稳定的210At半衰期最长,只有8.3小时。金属性较其它卤族元素强。熔点302℃(估计),沸点337℃(估计)。易挥发,易溶于苯,四氯化碳等有机溶剂。化学性质与碘相似,比碘易氧化、难还原。1940年美国人考尔森、麦肯齐和西格雷用α粒子(氦离子)轰击铋,第一次制得210At。半衰期为7.5小时。砹的原文是“不稳定”的意思。在地壳中砹的总量少于28.35克,它多是天然放射性元素如镭、锕、钍等的蜕变产物。供研究用的砹都是人工合成的,由高能α粒子轰击铋原子核而得。
[氧]元素符号O,原子序数8,原子量15.9994,外围电子排布2S2 2p4,位于第二周期第ⅥA族。原子共价半径66皮米,离子半径O2-132皮米,第一电离能1314千焦/摩尔,电负性3.5。氧元素有两种同素异形体,氧气O2和臭氧O3。氧分子有明显的顺磁性,这是因为O2分子是由一个σ键和两个三电子π键构成的,两个三电子π键有两个未成对电子,所以O2 是顺磁性的。氧气在通常状况下为无色、无臭、无味的气体,密度1.429克/升(气),1.149克/厘米3(液)、1.426克/厘米3(固)。熔点-218.4℃、沸点-182.962℃。主要氧化数为-2,在氟化氧中为+2,在过氧化物中为-1。液氧呈淡蓝色,固态氧为蓝色晶体。微溶于水,在水中溶解度为4.89毫升/100毫升水(0℃)。由于离解能较大(498.1千焦/摩尔),所以常温下氧气化学性质不甚活泼,高温下化学性质很活泼,能与大多数元素化合生成一种或一种以上氧化物或过氧化物。有氧化性是重要的氧化剂。纯氧大量用于金属熔炼、精炼、焊接、切割和表面处理过程。在化学工业上常用纯氧强化生产过程。液体氧用作致冷剂,也是高能燃料的氧化剂。它和锯屑、煤粉的混合物是液氧炸药。纯氧也用于航空、潜水和医疗中。天然存在的氧由16O(99.759%)、17O(0.037%)、18O(0.204%)三种同位素组成。在地壳中的丰度为49.5%,占第一位。大部分以水、氧化物、硅酸盐的形式存在。干燥空气中含20.946%体积的氧气。在1773年瑞典的舍勒分解硝酸盐和利用浓硫酸与二氧化锰反应制得氧气。1774年英国的普利斯特里加热氧化汞制得氧气。工业上用分馏液体空气制得,也可用电解水制得较纯的氧气。实验室常用氯酸钾与二氧化锰(催化剂)混合加热制取。
[臭氧]化学式O3,式量47.998,氧元素的一种同素异形体。有鱼腥气味的淡蓝色气体。密度2.144克/升;液态臭氧是深蓝色,密度1.614克/厘米3,沸点-111.9℃,固态臭氧是蓝黑色,熔点-192.7℃。分子呈V形。不稳定。常温下分解较慢,在164℃以上或有催化剂存在时或用波长为25纳米左右的紫外线照射臭氧时加速分解成氧气。液态时容易爆炸。臭氧有强氧化性,是比氧气更强的氧化剂,可在较低温度下发生氧化反应,如能将银氧化成过氧化银,将硫化铅氧化成硫酸铅、跟碘化钾反应生成碘。松节油、煤气等在臭氧中能自燃。有水存在时臭氧是-种强力漂白剂。跟不饱和有机化合物在低温下也容易生成臭氧化物。用作强氧化剂,漂白剂、皮毛脱臭剂、空气净化剂,消毒杀菌剂,饮用水的消毒脱臭。在化工生产中可用臭氧代替许多催化氧化或高温氧化,简化生产工艺并提高生产率。液态臭氧还可用作火箭燃料的氧化剂。存在于大气中,靠近地球表面浓度为0.001-0.03ppm,是由大气中氧气吸收了太阳的波长小于185纳米紫外线后生成的3O2 +hv=2O3。实验室和工业上都是将氧气在无声放电作用下制得。
[液氧炸药]由可燃性固体吸收剂跟液态氧组成的爆炸混合物。一般用炭黑、锯屑或金属粉等作吸收剂。先将吸收剂包裹成圆柱状,浸入液氧中,使吸收剂空隙充满液氧,即成液氧炸药。用雷汞或导火索起爆。广泛用于露天采矿和土木工程的爆破。是一种比较安全的炸药。空气中臭氧层使人类免受紫外线的伤害。
[硫]元素符号S,原子序数16,原子量32.06,外围电子排布3S2 3p4,位于第三周期第ⅥA族,主要氧化数-2、0、+2、+4、+6。原子共价半径104皮米,离子半径S-2184皮米,S+630皮米,第一电离能1000千焦/摩尔,电负性2.5。单质硫俗称硫磺。黄色晶体。有多种同素异形体,斜方硫又叫菱形硫或α-硫,在95.5℃以下最稳定,密度2.1克/厘米3,熔点112.8℃,沸点445℃,质脆,不易传热导电,难溶于水,微溶于乙醇,易溶于二硫化碳;单斜硫又称β-硫,在95.5°以上时稳定,密度1.96克/厘米3;弹性硫又称γ-硫是无定形的,不稳定,易转变为α-硫。斜方硫和单斜硫都是由S8环状分子组成,液态时为链状分子组成,蒸气中有S8、S4、S2 等分子,1000℃以上时蒸气由S2 组成。化学性质比较活泼,能跟氧、氢、卤素(除碘外)、金属等大多数元素化合,生成离子型化合物或共价型化合物。硫单质既有氧化性又有还原性。如硫跟铁共热生成硫化亚铁,跟碳在高温下生成二硫化碳,常温下跟氟化合生成六氟化硫,加热时跟氯化合生成S2 Cl2。硫在工业上主要用于制硫酸、硫化橡胶、黑火药、火柴、硫化物等。农业上用作杀虫剂,如石灰硫磺合剂,还用于制医药,如硫磺软膏。古代人已认识了天然硫。硫以游离态和化合态存在于自然界中,化合态主要有硫化物和硫酸盐。在地壳中的丰度为0.048%。从天然硫矿制得,或将黄铁矿和焦炭混和在有限空气中燃烧制得。
3FeS2 +12C+8O2 =Fe3O4 +12CO+6S
[硫化氢]化学式H2 S,式量34.08,有腐卵臭味的无色气体,有毒。分子结构与水相似,呈V形,有极性。密度1.539克/升,熔点-85.5℃,沸点-60.7℃。能溶于水,水溶液叫氢硫酸,还能溶于乙醇和甘油。完全干燥的硫化氢常温下不与空气中氧气反应,点火时可燃烧、有蓝色火焰。空气充足时生成二氧化硫和水,若空气不足或温度较低时生成硫和水。能使银、铜制品表面变黑,生成金属硫化物。有较强的还原性,跟二氧化硫反应生成硫和水,跟浓硫酸反应生二氧化硫和硫,跟氯气反应生成硫和氯化氢,跟三价铁盐溶液生成二价铁盐和硫,使硝酸还原为二氧化氮,使I2还原为I-,使MnO-4还原为Mn2+,反应中H2 S通常被氧化为S,若氧化剂氧化性较强并过量时,H2 S还可能被氧化成H2 SO4 。H2 S能跟多种金属离子反应可成不溶于水和酸的硫化物沉淀。用于分离和鉴定金属离子,精制盐酸,制备单质硫。由硫化亚铁跟盐酸或用硫蒸气跟氢气化合制备。
[氢硫酸]化学式H2 S,式量34.08,硫化氢的水溶液叫氢硫酸,有腐卵臭味。是很弱的酸,在18℃时的电离常数为:K1=9.1×10-8, K2=1.1×10-12。在空气中易被氧化析出硫,溶液变浑浊。
[二氧化硫]化学式SO2 ,式量64.08,又名亚硫酸酐。分子呈V形结构,有极性。无色有刺激性气味的气体,有毒。密度2.927克/升(气)、1.437克/厘米3(液),熔点-72.7℃,沸点-10℃。易溶于水,通常情况下每升水可溶40升SO2 ,和水化合生成H2 SO3,也溶于乙醇。是酸性氧化物。有还原性,在催化剂作用下被氧气氧化成三氧化硫,跟二氧化氮反应生成三氧化硫和一氧化氮。遇强还原剂表现有氧化性,如跟硫化氢反应生成硫和水。跟氯化合生成SO2 Cl2,有漂白性:跟某些色素生成不稳定的无色化合物。用于制三氧化硫、硫酸、亚硫酸盐;还用于漂白、杀菌、制合成洗涤剂、致冷剂、有机溶剂、精制润滑油。是大气主要污染物之一,工业上要求空气中含量不得超过0.02毫克/升。实验室用硫酸跟亚硫酸钠或亚硫酸氢钠反应制得。工业上用燃烧硫或煅烧金属硫化物(如黄铁矿FeS2 )制得。
[三氧化硫]又称硫酸酐,化学式SO3。式量SO3为80.06。无色固体,易挥发。熔点16.8℃,沸点44.8℃。密度2.29克/厘米3(-10℃)。液体密度1.92克/厘米3(20℃)。蒸气状态的分子为平面三角形。固态时有三种变体,较重要的有α型和β型。α型是冰状结构的三聚体(SO3)3,β型是与石棉结构相似的(SO3)n结构。极易吸水,溶于水生成硫酸,并放出大量热。在空气中强烈冒“烟”。溶于浓硫酸生成发烟硫酸。是酸性氧化物,跟氧化镁反应放热发强白光。有强氧化性是强氧化剂,高温时氧化磷,生成五氧化二磷和二氧化硫,氧化碘化钾,生成碘和亚硫酸钾。用于制硫酸、氯磺酸及有机化合物的磺化。将二氧化硫和氧气在五氧化二钒催化作用下制得。
[硫酸]化学式H2 SO4 ,式量98.08。纯硫酸为无色油状液体。市售浓硫酸含H2 SO4 96-98%,密度1.841克/厘米3。凝固点10.4℃,沸点338℃(98.3%)浓硫酸有强烈吸水性,能与水以任意比混溶,并放出大量热,这是水合作用的结果。用水稀释浓硫酸时,只能在搅拌下将浓硫酸徐徐注入水中,切勿将水注入浓硫酸中。有强烈脱水性,从有机物中按水的组成夺取氢、氧原子,并能使某些有机物碳化。硫酸是二元强酸,纯硫酸中存在大量未电离分子,几乎不导电。它的水溶液导电,第一步电离完全,第二步电离不完全K2=1.2×10-2。稀硫酸具有酸的通性,其中H+也有氧化性。浓硫酸有强氧化性,可以氧化金、铂等以外的大多数金属和许多非金属,如:
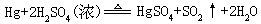
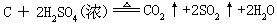
铁、铝、铬等在冷、浓硫酸中发生钝化。浓硫酸将H2 S氧化析出硫,将NaBr氧化生成溴,将KI氧化生成碘。跟苯等有机物发生磺化反应。硫酸是化学工业中最重要的产品之一,广泛用于生产化肥、农药、染料、炸药、人造纤维、精炼石油、冶金、金属加工、有机合成、铀矿加工等。工业上用接触法或铅室法制硫酸。接触法是以硫或黄铁矿(FeS2 )为原料,在空气中燃烧生成二氧化硫,在五氧化二钒催化剂作用下,二氧化硫被氧化生成三氧化硫,用98.3%的硫酸吸收三氧化硫,再用水稀释制得。
[焦硫酸]化学式H2 S2 O7,式量178.02。无色晶体,熔点35℃。溶于水生成硫酸:
H2 S2 O7+H2 O=2H2SO4
焦硫酸具有比浓硫酸更强的氧化性,用于制染料,炸药和其它有机磺酸化合物。由等摩尔的SO3和纯硫酸化合而成:
H2SO4 +SO3=H2S2 O7
当冷却发烟硫酸时可以析出焦硫酸晶体。
[硫酸酐]见三氧化硫条。
[亚硫酸酐]见二氧化硫条。
[硫华]硫升华得到的粉状硫,主要组分是斜方硫。用于橡胶硫化、配制药膏、制杀虫剂和杀菌剂等。
[亚硫酸]化学式H2 SO3,式量82.08,二氧化硫的水溶液叫做亚硫酸。没有得到游离的纯亚硫酸,只存在于水溶液中,不稳定,易分解出二氧化硫,因而有刺激性嗅味。水溶液存在下列平衡:
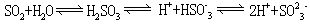
亚硫酸是中等强度的二元酸。 25℃时K1=1.54×10-2,K2=1.02×10-7。加热时驱出SO2 ,平衡向左移;加入碱时,平衡向右移动,生成酸式盐或正盐。具有氧化性和还原性,还原性强于氧化性。在碱性介质中是一良好的还原剂。能和许多有色有机物发生加成反应,生成无色化合物。用于漂白羊毛、蚕丝、麦杆。还用作还原剂,药物合成,造纸,石油产品炼制,消毒杀菌等。将二氧化硫通入水中制得。
[发烟硫酸]化学式H2SO4 ·xSO3。将三氧化硫溶解在浓硫酸中所形成的溶液称为发烟硫酸。无色油状液体。其密度、熔点、沸点随着三氧化硫的含量不同而改变。通常以游离SO3的含量未标明不同浓度的发烟硫酸,如40%发烟硫酸即表示在发烟硫酸中含有40%游离的SO3。一般使用的有20%发烟硫酸,密度为1.9克/厘米3,熔点-11℃,沸点166.6℃。发烟硫酸暴露在空气中,挥发出来的SO3,和空气中的水蒸气形成硫酸细小液滴而“发烟”。有吸水性、腐蚀性、脱水性,强氧化性。用作硝酸脱水剂、有机合成的磺化剂、有机硝化反应中的脱水剂。还用于精炼石油。
[硫代硫酸]化学式H2S2 O3,式量114.14。仅存在溶液中。不稳定,45℃分解,生成水、二氧化硫、硫。硫代硫酸可看成是硫酸分子中的一个氧原子被硫原子所代替的产物。两个硫原子的平均氧化数为+2。其中一个硫原子氧化数为+6,另一个硫原子氧化数为-2,因此硫代硫酸及其盐类具有一定的还原性。硫代硫酸根酸离子在碱性条件下很稳定,有很强的络合能力。
[硫氰酸]可能有两种同分异构体,一为硫氰酸H-S-C≡N,一为异硫氰酸H-N=C=S。游离酸还没有分离出来。大多数硫氰酸盐都溶于水。SCN-离子是一个很好的配位体。SCN-离子一个特殊灵敏的反应是与Fe3+形成多种红色络合物。因此硫氰酸钾或硫氰酸铵常用作检验Fe3+的试剂。
[硒]元素符号Se,原子序数34,原子量78.96,外围电子排布4S2 4p4,位于第四周期第ⅥA族。主要氧化数-2、+2、+4、+6。原子共价半径117皮米,离子半径Se-2191皮米,Se+642皮米。第一电离能941千焦/摩尔,电负性2.4。单质硒的组成和分子结构随着外界条件而变化,能形成多种同素异形体:α单斜晶体、β单斜晶体、有金属光泽的灰色三角晶体,还有红色、黑色的无定形玻璃状硒。灰黑色硒最稳定,通常称为金属硒。密度4.79克/厘米3,熔点 217℃,沸点684.9℃。性脆,是一种典型的半导体。室温时在空气中稳定。加热时,硒在空气中燃烧发出蓝色火焰,生成二氧化硒。能跟氟、氯、金属直接化合。不与水、盐酸、稀硫酸反应。能跟浓硫酸、浓硝酸和强碱反应。用于制整流器、光电池、光度计、玻璃、陶瓷、催化剂、油漆等。1817年,瑞典的贝采里乌斯从硫酸厂铅室底部的物质中制得硒。硒是一种稀散元素,地壳中的丰度为9.0×10-6%。工业上从电解铜的阳极泥和硫酸厂的烟道灰,酸泥的废料中回收得到。
[碲]元素符号Te,原子序数52,原子量127.60。外围电子排布5S2 5p4,位于第五周期第ⅥA族。主要氧化数-2、+2、+4、+6。原子共价半径137皮米,离子半径Te-2211皮米,Te+650皮米,第一电离能869千焦/摩尔,电负性2.1。有结晶形和无定形两种同素异形体。结晶碲具有银白色的金属外观,密度6.25克/厘米3,熔点452℃,沸点1390℃,硬度2.5。无定形碲为褐色,密度6.0克/厘米3,熔点449.5±0.3℃,沸点989.8±3.8℃。碲在空气中燃烧发出蓝色火焰,生成二氧化碲,可与卤素反应,能溶于硫酸、硝酸、氢氧化钾和氰化钾溶液。易传热和导电。主要用于石油裂化的催化剂,电镀液的光亮剂、玻璃的着色材料,添加到钢材中以增加其延性,添加到铅中增加它的强度和耐蚀性。碲和它的化合物又是一种半导体材料。1782年,奥地利人缪勒从一种呈白而略带蓝的碲金矿里制得碲,1798年德国矿物学家克拉普罗特确定它为一新元素并命名,希腊文的原意是“地球”的意思。碲是一种稀散元素,地壳中的丰度为2.0×10-7%。工业上从电解铜的阳极泥或炼锌的烟尘中回收制取。
[钋]元素符号Po,原子序数84,原子量210,外围电子排布6S2 6p4,位于第六周期第ⅥA族,原子共价半径167皮米,Po+667皮米,第一电离能 818千焦/摩尔,电负性2.0。金属单质,外观与铅相似,质软。所有钋的同位素都有放射性。有两种同素异形体,α-Po密度 9.32克/厘米3,单正方体,β-Po密度9.4克/厘米3,单菱形体。熔点254℃,沸点962℃。主要氧化数+2、+4、+6。较同族碲金属性强。溶于浓硫酸、硝酸、稀盐酸、王水和稀氢氧化钾溶液。钋的化合物易水解并被还原。于1898年居里夫妇从沥青铀矿中分离出钋,为纪念居里夫人的祖国波兰命名为钋。世上最稀有的元素之一。它与铍混和可作中子源,也用作静电消除剂。天然的210Po,半衰期为138.4天。目前可用中子轰击铋,产生以毫克计的210Po,也可用锌还原氯化钋制得。
[氮]元素符号N,原子序数7,原子量14.01,外围电子排布2s22p3,位于第二周期第VA族。共价半径74皮米,离子半径(N3-)171皮米,(N+5)13皮米,第一电离能1402千焦/摩尔,电负性3.0。氮气(N2)是无色、无嗅、无味气体,密度1.25克/升(气),0.8081克/厘米3(液),熔点-209.86℃,沸点为-195.8℃。氧化数有+1、+2、+3、+4、+5、-1、-2、-3。氮气分子中核间距离为109.5皮米,分子中含有一个σ键和两个π键,两个氮原子间形成三个共价键,每个氮原子的2s电子为孤电子对。氮气分子很稳定,分子的离解能为946千焦/摩尔,加热到3000℃也不分解,比其它双原子分子都稳定。所以氮在常温下不活动。难溶于水,常温下每一体积水大约溶0.02体积氮。在高温时氮气可跟许多金属、非金属锂、钙、镁、铍、锶、钡、铬、钛、硅、硼等形成氮化物;跟氧化合成一氧化氮;在适当温度和压强并有催化剂存在条件下,跟氢化合生成氨;当超过1800℃时,氮、碳与氢化合生成氰化氢。利用氮气的不活动性,用作充填灯泡、焊接金属的保护气,保存粮食,水果等农副产品。还用于制取氨、硝酸、氰氨化钙、氰化物、尿素等。液态氮用作低温致冷剂,15N常用作示踪同位素。地壳中含氮0.0046%(质量百分数),绝大部分以游离态形式存在于大气中(约占大气体积的78%)。化合态则以多种形式存在,并且是动植物体的蛋白质的重要组成元素。主要矿物是硝酸钠。1772年,英国的丹尼尔·卢瑟福从磷和空气作用后剩下的气体中发现了氮。工业上采用大规模蒸发液态空气方法大规模制取氮。实验室中将亚硝酸钠溶液慢慢加到热饱和氯化铵溶液中制取氮气。
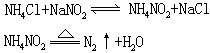
将氨通过热氧化铜,可得纯净的氮
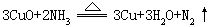
叠氮化钠热分解可制得光谱纯氮。
[液态氮]无色无臭的液体。熔点-209.8℃,沸点-195.8℃。密度0.808克/厘米3,临界温度-146.89℃,临界压力3287±2千帕(33.54±0.02大气压)。主要用于获得低温的冷冻剂,广泛应用于制备稀有气体,低温手术、半导体工业以及超导等科研中。
[一氧化氮]化学式NO,式量30,分子中含有sp杂化轨道形成的共价键,一个σ键,一个双电子π键,一个三电子π键。它是含有奇数价电子的分子。通常为无色气体、液态、固态时呈蓝色。固态时有微弱的很松弛的双聚体N2O3存在。密度1.34克/升(气),1.269克/厘米3(液),熔点-163.6℃,沸点-151℃。微溶于水,不与水反应。较易溶于乙醇。在1000℃以上时才被分解。常温下易跟氧化合生成二氧化氮。能跟氟、氯、溴等化合生成卤化亚硝酰,如:
2NO+Cl2=2NOCl
由于分子中存在孤电子对,可以跟金属离子络合,如跟硫酸亚铁溶液形成棕色可溶性的硫酸亚硝基合铁(Ⅱ):
FeSO4+NO+[Fe(NO)]SO4
高温时表现有氧化性。汽车尾气中含有此气,是大气的一种污染源。是工业制硝酸的中间产物。由铜跟稀硝酸反应或由氨催化氧化制得。
[一氧化二氮]俗称笑气。化学式N2O2,式量44.02。无色气体,有微甜气味和微甜味道。密度1.977克/升,熔点-90.8℃,沸点-88.5℃。溶于水和乙醇,但不与水反应。室温时不活动。加热至500℃以上分解为氮气和氧气。高温时跟碱金属及许多有机物反应。有麻醉作用,吸入极少量时刺激面神经使人发笑。用作外科或牙科的麻醉剂及食物溶胶。用硝酸铵在熔融状态下分解制得。
[二氧化氮]化学式NO2,式量46.01。红棕色气体,有刺激性气味。分子有顺磁性。密度为l.4494克/升,熔点-11.2℃,沸点21.2℃,有毒!二氧化氮可以互相化合生成无色的四氧化二氮气体,常温下两种气体共存处于平衡状态。低于0℃时几乎都以四氧化二氮存在,为无色晶体,有抗磁性。140℃以上时全部转为NO2,加热至150℃以上时分解为NO和O2。溶于水生成硝酸和一氧化氮(或硝酸和亚硝酸)
3NO2+H2O=WHNO3+NO
溶于碱溶液生成硝酸盐和亚硝酸盐
2NO2+2NaOH=NaNO3+NaNO2+H2O
溶于浓硝酸生成发烟硝酸。有强氧化性(比硝酸强),碳、硫、磷等可在二氧化氮中燃烧。可跟许多有机物发生剧烈反应。用作氧化剂、有机反应中的硝化剂,铅室法制硫酸用作催化剂。由铜跟浓硝酸反应制得。
[三氧化二氮]化学式N2O3,式量76.02。固态时为浅蓝色,液态时为深蓝色。纯的仅以固态形式存在。密度1.447克/厘米3(2℃,液),熔点-102℃,3.5℃时分解,室温时几乎完全分解为一氧化氮和二氧化氮。温度低于-20℃时稳定。溶于碱溶液生成亚硝酸盐。将等摩尔的一氧化氮和二氧化氮混合冷却到-21℃,可制得。
[五氧化二氮]化学式N2O5,式量108.02。白色斜方晶体,密度1.642克/厘米3,熔点30℃,沸点47℃(分解)。溶于水,跟水化合生成硝酸,易潮解。不稳定,易分解生成二氧化氮和氧气。有强氧化性,是强氧化剂。用五氧化二磷跟纯的无水硝酸经脱水反应制得。
[硝酸]化学式HNO3,式量63.01。纯硝酸为无色透明油状液体,易挥发,有刺激性气味,密度1.503克/厘米3,熔点-42℃,沸点83℃。易溶于水。一般市售浓硝酸密度约为1.42克/厘米3,含HNO365-70%,受热或见光可分解出二氧化氮,故呈红棕色。溶解过多的二氧化氮的浓硝酸称为发烟硝酸。属于强酸,有强氧化性和硝化性。有强腐蚀性,溅到皮肤上引起疼痛并变黄。能将灼热的碳氧化成二氧化碳,使硫氧化成硫酸,使磷氧化成磷酸。常温下浓硝酸能使铝、铁、铬钝化,阻止进一步被氧化腐蚀。除金、铂外,硝酸能溶解大多数金属,生成硝酸盐,而硝酸被还原生成NO2、NO或NH4NO3等。1体积浓硝酸与3体积浓盐酸的混和液称为王水,有强氧化性,可溶解金、铂。硝酸是重要基本化工原料,广泛应用于制染料、炸药、医药、塑料、氮肥、化学试剂以及用于冶金、有机合成。实验室由浓硫酸与硝酸钠共热制取。工业上主要用氨氧化法制取。
[亚硝酸]化学式HNO2,式量47.02。是三价氮的含氧酸,酸酐为三氧化二氮。亚硝酸仅存在于稀溶液中,溶液显微蓝色。很不稳定,受热即分解为NO2、NO和H2O。是弱酸(略强于醋酸)。既有氧化性又有还原性。用于有机合成中伯胺的重氮化反应。可将等摩尔的NO2和NO混和物通入冷水中制得。工业上用亚硝酸钠跟盐酸反应制得。
[氨]化学式NH3,式量17.03。分子中氮原子是以不等性sp3杂化的。在四个杂化轨道中有三个轨道和三个氢原子结合形成三个σ键,另一个轨道为不成键的孤电子对占有。由于孤电子对对成键电子对的排斥,N-H键间的夹角为106.6°,因此氨分子结构是三角锥形,氮原子位于锥顶,三个氢原子位于锥足,又因这一对孤电子对电子云较多地分布在氮原子的上部,因此使氨分子有很大的极性,同时表现出很强的加合性。氨分子的结构特点决定了氨分子的特性。液态和固态氨的分子间存在着氢键。氨是无色有强刺激性气味的气体。密度0.7710克/升(标准状况),熔点-77.7℃,沸点-33.35℃,临界温度132.9℃,临界压力11342.3千帕(112.3大气压)。氨在常温下很容易加压成为无色液体,也易凝固为雪状固体。极易溶于水,在标准状况下1体积水可溶解1200体积氨,在20℃时,1体积水可溶解700体积氨。溶液显碱性。易溶于乙醇和乙醚。液氨是良好的极性溶剂。液氨有微弱的电离作用
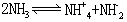
液氨能溶解碱金属,生成深蓝色溶液,很浓的碱金属氨溶液是强还原剂。氨通常很稳定。高温时可分解为氢气和氮气。有还原性,在纯氧气中燃烧显黄色火焰,生成氮气和水。在铂催化作用下,加热时会被氧化生成一氧化氮。通过加热的氧化铜时,可夺取其中氧
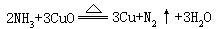
在常温下,氨在水溶液中能被许多强氧化剂(Cl2、H2O2、KMnO4、NaClO等)氧化,如:
3Cl2+3NH3=N2+6NH4Cl
氨分子可发生取代反应,氨分子中的氢原子可被其它原子或原子团取代,生成氨基-NH2,亚氨基=NH和N≡的一系列氨的衍生物。取代反应的另一种形式是氨以氨基或亚氨基取代其它化合物中的原子或基团,如:
HgCl2+2NH3=Hg(NH2)Cl↓+NH4Cl
氨基氯化汞
氨还能进行加合反应,氨分子中氮原子上的孤电子对能跟其它离子或分子形成共价配位键;氨跟酸反应,生成铵盐,氨跟许多金属离子(Ag+、Cu2+、Cr3+、Zn2+等)及BF3分子形成氨络离子和络合物:[Ag(NH3)2]+、[Cu(NH3)4]2+、[Cr(NH3)6]3+、BF3·NH3。氨有广泛用途,可用于制液氨、氨水、硝酸、尿素、铵盐、塑料、染料、及医药等。氨水和铵盐可作化肥、无水氨可作致冷剂。实验室用铵盐跟熟石灰混和共热制得。工业上用氢氮混合气体在加热、加压、催化剂作用下合成。
[氨水]氨的水溶液,无色有强烈刺激性气味。氨含量越多,密度越小。一般市售浓氨水的密度为0.91克/厘米3,浓度约为28%(质量百分数)。最浓的氨水密度为0.88克/厘米3,浓度为35.28%(质量百分数)。在氨水中既有自由的氨分子,也有水合氨分子和铵离子,主要形成水合氨分子,实质上是氨分子和水供给的氢以配位键相结合形成的。只有一小部分水合氨分子电离成铵根离子和氢氧根离子,故溶液显弱碱性。在氨水中存在下列平衡:
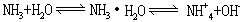
25℃时,氨水的电离常数为K=1.8×10-5。氨水吸收二氧化碳,生成碳酸氢铵;吸收二氧化硫,生成亚硫酸铵或亚硫酸氢铵。在常温下氨水可被Cl2、KMnO4等强氧化剂氧化。跟酸反应生成铵盐。跟Ag+、Cu2+、Cr3+、Zn2+等金属离子作用生成络离子。氨水可用作化学试剂、化肥、洗涤剂、消毒剂、医药。将氨气通入水中制得。
[联氨]别名肼,化学式NH2-NH2。无色油状液体,与水、乙醇互溶。熔点2℃,沸点113.5℃,有氨的气味,剧毒。联氨可看做是氨分子内的一个氢原子被氨基取代的衍生物。有碱性,可与无机酸反应生成盐。在水溶液中既显氧化性又显还原性。在酸性溶液中是强氧化剂。在强碱性溶液中是强还原剂。有强腐蚀性,可腐蚀玻璃、橡胶、软木等。有可燃性:
N2H4(液)+O2(气)=N2(气)+2H2O(液)+624千焦
用作火箭燃料,医药原料,也常用作还原剂、显影剂。先用氯跟稀氨水反应制得氯氨NH2Cl,然后加过量氨即得联氨。
2NH3+Cl=NH2Cl=NH4Cl
2NH3+NH2Cl=N2H4+NH4Cl
[氯化铵]化学式NH4Cl,式量53.49。天然产物称“硇砂”。无色立方晶体,密度1.527克/厘米3,熔点340℃(升华),沸点520℃,易溶于水微溶于醇,加热时,易分解为氨和氯化氢。跟碱共热可放出氨气。高温时跟金属氧化物反应。用于作干电池中的电解质,金属焊接时的助焊剂、媒染剂。配制电镀液,也可用作化肥,医疗上用作 痰药。是联合制碱法的副产物。
痰药。是联合制碱法的副产物。
[硫酸铵]简称硫铵。化学式(NH4)2SO3,式量132.14,无色斜方晶体。密度1.769克/厘米3,235℃分解。溶于水不溶于乙醇。工业品含氮约为20-21%。是一种速效肥料,适用于一般作物,最好用作追肥。还可用作焊药、织物防火剂等。工业上主要用硫酸跟氨反应制成。
[硝酸铵]简称硝铵。化学式NH4NO3,式量为80.04。无色单斜或斜方晶体。密度1.725克/厘米3,熔点169.6℃,沸点210℃,分解为水和一氧化二氮。剧烈加热可能引起爆炸。易溶于水、乙醇。溶于水时能吸收大量热而降温。易潮解。如加热高于300℃硝酸铵可分解为水、氮气和氧气。用于制笑气、烟火、炸药,也用作化肥、氧化氮吸收剂、致冷剂。用硝酸跟氨水作用制得。
[碳酸铵]化学式(NH4)2CO3·H2O,式量114.10。无色晶体或白色粉末,有氨味。溶于冷水。在空气中逐渐失去氨而生成碳酸氢铵。58℃时分解为氨、二氧化碳和水。
[碳酸氢铵]又称酸式碳酸铵或重碳酸铵。化学式NH4HCO3,式量79.06,无色单斜或斜方晶体。密度1.58克/厘米3,熔点107.5℃(分解)。溶于冷水,不溶于乙醇。不稳定,36℃以上时即分解为氨、二氧化碳和水,60℃时即迅速分解。有强烈的氨气味。用作肥料、灭火剂、发酵、医药等方面。将浓氨水通入二氧化碳、饱和后结晶制得。
[磷酸二氢铵]又称磷酸一铵。化学式NH4H2PO4,式量115.03。无色四方晶体,密度1.803克/厘米3,熔点190℃。溶于水显弱酸性。在空气中稳定。高于熔点时分解出氨和水,形成偏磷酸铵(NH4PO3)x和磷酸混和物。用作磷氮复合肥料、木材、纸张、织物的防火剂(如作火柴梗的灭烬剂),还用作制药、压电晶体。用磷酸跟氨水作用制得。
[亚硝酸铵]化学式NH4NO2,式量64.048。浅黄色菱形晶体。密度1.69克/厘米3,易溶于水和乙醇。不稳定,常温时即逐渐分解为氮和水,受热时分解加快,浓溶液比干燥的晶体分解要快。当温度高于60℃时强烈的爆炸。用NH4ClO4温溶液跟KNO2温溶液混和冷却,析出难溶的KClO4晶体,制得NH4NO2溶液。
[重铬酸铵]别名红矾铵,化学式(NH4)2Cr2O7,式量252.06。橙红色晶体,溶于水,不溶于醇。密度2.15克/厘米3。在168℃时分解(反应时出现火焰),生成松散绿色Cr2O3粉末
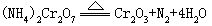
与多种有机物接触、摩擦、撞击引起燃烧或爆炸。有腐蚀性,有毒。用作分析试剂、媒染剂、氧化剂、香料合成、照像制版。将CrO3溶于水,控制温度在15℃以下分次少量加入氨水到中性、冷却、结晶制得。
[氢叠氮酸]化学式HN3,式量43.03。无色有刺激性气味的液体,沸点35.8℃,熔点-80℃。是易爆物质,受到撞击立即爆炸、分解。
2HN3=3N2+H2
稀溶液几乎不分解。HN3为弱酸Ka=1.9×10-5。用稀硫酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:
NaNH2+N2O=NaN3+H2O
[氰化氢]化学式HCN,式量27.028。又称甲腈。无色液体,有苦杏仁气味,气体密度0.901克/升,液体密度0.699克/厘米3。熔点-14℃,沸点26℃。易挥发,剧毒。0.05克即可致死。分子有极性,分子间易发生缔合作用。极易溶于水,水溶液称氢氰酸,极弱酸,K=2.1×10-9。易溶于醇和醚。燃烧时显蓝色火焰。溶液跟氯气反应生成氯化氰和盐酸。与浓无机酸反应生成氨和甲酸。用于制备氰化物、丙烯腈、染料、杀虫剂、熏蒸剂等。工业上用甲烷、氨和氧气在800℃铂催化条件下制得。实验室用氰化钠浓溶液跟稀硫酸混合蒸馏制得。
[氢氰酸]见氰化氢条。
[磷]元素符号P,原子序数15,原子量30.97。外围电子排布3s23p3,位于第3周期第ⅤA族。共价半径 110皮米,P3-半径212皮米,P+5半径为35皮米,第一电离能1011.8千焦/摩尔,电负性2.1。单质磷有几种同素异形体,其中白磷或黄磷是白色或淡黄色腊状晶体,是由P4分子组成的分子晶体,P4分子是四面体构型。密度1.82克/厘米3,熔点44.1℃,沸点280℃,着火点40℃,有蒜臭气味,有剧毒,致死量为60-100毫克。难溶于水,易溶于二硫化碳,在气态和溶液中以P4形式存在。白磷在潮湿空气中缓慢氧化,部分反应的能量以光能的形式释放出来,故在暗处可看到磷光。白磷在空气中经缓慢氧化,积蓄热量使温度达到着火点,引起自燃。白磷隔绝空气加热到400℃数小时可转化为红磷。红磷是暗红色粉末,是磷的一种稳定变体,无定形体。密度2.2克/厘米3,不溶于水和二硫化碳等一般溶剂,熔点590°(4355.9千帕--43大气压),沸点200℃,着火点240℃。无毒。在416℃时红磷升华,它的蒸气冷却后变成白磷。在1.2×109千帕(12000大气压)和200℃时,白磷可转变成一种黑色同素异形体--黑磷,它有石墨状片层结构,呈铁灰色,有金属光泽,能导电,密度2.25-2.69克/厘米3,燃点490℃。白磷化性活动,红磷次之,黑磷化学活动性最差。磷的各种单质都能燃烧生成五氧化二磷;白磷、红磷都易与卤素化合,生成三卤化磷或五卤化磷。白磷溶于热浓碱液中生成磷化氢和次磷酸盐,如:
P4+3KOH+3H2O=PH3↑+3KH2PO2
白磷可跟金、银、铜、铅盐溶液反应。如:
2P+5CuSO4+8H2O=5Cu+2H3PO4+5H2SO4
11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4
白磷用于制磷酸、燃烧弹、烟雾弹、杀鼠药等。红磷用于制火柴和农药等。1669年德国的布兰特从人尿蒸馏和干馏后的物质中制得白磷。自然界中磷以磷酸盐的形式存在,主要矿石有磷灰石。磷也构成生物体的重要元素,存在于细胞、骨骼、蛋白质中。工业上将磷酸钙、二氧化硅和焦炭混和在电炉中反应制得白磷。
[五氧化二磷]化学式P2O5,式量141.94,化学式也可写作P4O10。白色粉末。密度2.39克/厘米3。于300℃升华,熔点580-585℃,有强烈吸水性和脱水性,在空气中极易潮解,易溶于水并跟水化合、跟少量冷水反应生成偏磷酸HPO3,跟热水反应生成磷酸H3PO4,所以五氧化二磷也叫磷酸酐。用作气体或液体的干燥剂,有机合成的脱水剂,制造纯磷酸。将磷在干燥空气中燃烧制得。
[磷化氢]化学式PH3,式量34.00。无色类似大蒜气味的剧毒气体。密度1.529克/升,熔点-133.5℃,沸点-87.4℃。微溶于水,溶于乙醇和乙醚。含有联膦P2H4或P4蒸气时,可自燃生成磷酸
PH3+2O2=H3PO4
受热易分解。与卤化氢化合生成卤化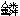 ,如PH4Cl。有较强的还原性,能跟Cu2+、Ag+、Au3+的盐溶液反应还原出金属。与过渡元素形成络合物。用于制备有机化合物。由磷化钙或其它磷化物水解生成。
,如PH4Cl。有较强的还原性,能跟Cu2+、Ag+、Au3+的盐溶液反应还原出金属。与过渡元素形成络合物。用于制备有机化合物。由磷化钙或其它磷化物水解生成。
[磷酸]也称正磷酸,化学式H3PO4,式量97.994。纯品为无色斜方晶体。密度1.843克/厘米3,熔点42.35℃。市售浓磷酸是粘稠液体(约含85-98%)。易潮解,溶于水和乙醇。是三元中强酸,在25℃时电离常数K1=7.5×10-3,K2=6.2×10-8,K3=2.2×10-13。加热至213℃时失去部分水变为焦磷酸H4P2O7,进一步脱水生成偏磷酸HPO3。磷酸稳定,400℃以下无氧化性。无毒,有腐蚀性,可腐蚀石英。用于制磷酸盐、复合肥料、磷酸酯萃取剂、染料、合成洗涤剂、医药、还用于金属酸洗及防锈。工业上用磷灰石Ca3(PO4)2跟硫酸反应制得,用硝酸跟磷反应可制得较纯磷酸。
[偏磷酸]化学式HPO3,式量79.98,无色玻璃状体,易潮解,密度2.2-2.5克/厘米3,易溶于水并生成正磷酸H3PO4有毒。用作化学试剂、脱水剂、催化剂。由磷酸高温脱水或由五氧化二磷跟适量水反应制得。
[磷酸酐]见五氧化二磷条。
[安福粉]是复合肥料磷酸铵的商品名称。
[砷]元素符号As,原子序数33,原子量74.93,外围电子排布4s24p3,共价半径121皮米,离子半径As3-222皮米,As+546皮米,第一电离能859.7千焦/摩尔,电负性2.0。位于第四周期第ⅤA族。主要氧化数有-3、+3、+5。俗名砒。有三种同素异形体:黄色的α体、黑色的β体和灰色的γ体。室温下最稳定的是γ体,有明显的金属性质,硬而脆,密度 5.73克/厘米3,熔点817℃(2836.4千帕--28大气压),613℃升华。气态分子组成为As4(800℃)。游离态砷化性很活泼,在空气中加热至200℃时有荧光出现,在400℃时燃烧呈蓝色火焰,并形成白色的氧化砷烟(As4O6),易与氟、氮化合,在加热时也易和大多数金属和非金属化合。不溶于水。能被硝酸或浓硫酸氧化生成砷酸,如:
3As+5HNO+2H2O=3H3AsO4+5NO
跟熔融氢氧化钠反应生成亚砷酸钠Na3AsO3并放出氢气。能溶于王水。砷及其化合物都有毒。砷在自然界分布很广,主要以化合态存在,少量以游离态存在。在地壳里丰度为5.0×10-4%,重要矿物有毒砂FeAsS、雄黄AsS、雌黄As2S3和白砷石As2O3等。1250年罗马的马格努斯用雄黄共热发现了砷。主要用途是与铅、铜、锌等制成合金,也用于制医药和杀虫剂以及半导体材料如砷化镓。由三氧化二砷跟碳反应制得。
[砷化氢]化学式AsH3,式量77.95。无色有恶臭的有剧毒的气体。密度2.69克/升,沸点-55℃,熔点-116.3℃。隔绝空气加热时分解为砷和氢气。在分析化学或法医常用以检测砷。室温时在空气中能自燃
2AsH3+3O2=As2O3+3H2O
砷化氢也叫胂。由砷化锌Zn3As2与稀硫酸反应可制得。用活泼金属在酸性溶液中使砷化合物还原也可制得:
As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O
[砷化镓]化学式GaAs,式量144.64。是一种重要的化合物半导体材料,同锗、硅比,其禁带宽度和电子迁移率都比较大,用它制造的器件有较好的频率特性和耐高温特性。用来制造微波半导体器件和半导体激光器。由镓和砷在高温下合成,再制成单晶体。
[三氧化二砷]别名亚砷酸酐,俗称砒霜,化学式As2O3,式量197.84。白色粉末,微溶于水。两性氧化物,溶于盐酸生成三氯化砷,溶于氢氧化钠和碳酸钠溶液生成亚砷酸钠。约193℃升华,剧毒,致死量约0.06克。用于制亚砷酸盐、医药、防腐剂。由砷燃烧制得。
[砷酸]化学式H3AsO4,式量141.94。无色透明晶体或白色粉末。有毒。有潮解性。溶于水、乙醇。溶于碱溶液生成砷酸盐。加热时可依次变为焦砷酸、偏砷酸。再变为五氧化二砷。主要用于制砷酸盐、杀虫剂和医药。用砷或三氧化二砷跟硝酸反应制得。
[砒霜]见三氧化二砷条。
[雄黄]矿物名。化学成分为AsS,也称鸡冠石。单斜晶系,晶体为柱状,大多成块状集合体。多数为桔红色。半透明,晶面有金刚光泽。密度3.5克/厘米3。难溶于水。质脆,有毒。用于提炼砷,制取三氧化二砷。还用于制颜料、玻璃、焰火。中医药用为解毒、杀虫药,外用治癣疥恶疮、蛇虫咬伤;内服微量治惊痫、疮毒等。
[雌黄]矿物名。化学成分为As2S3。单斜晶系,晶体常呈柱状。集合体呈短柱状,板状。柠檬黄色,有时微带浅褐色。有金刚光泽或珍珠光泽。质脆,解理完全。灼烧后发出强烈的蒜臭。用于提取三氧化二砷,制造玻璃、颜料等。
[锑]元素符号Sb,原子序数51,原子量121.75,外围电子排布5s25p3,位于第五周期第ⅤA族。共价半径141皮米,离子半径Sb-3245皮米,Sb+562皮米,第一电离能833.7千焦/摩尔,电负性1.9,主要氧化数(-3)、+3、+5。锑有几种同素异形体。通常最稳定的是灰锑,银白或银灰色菱形晶体,脆而硬,由液态凝固时体积膨胀,即有冷胀性,密度6.68克/厘米3,熔点 630.74℃,沸点1750℃,锑蒸气分子为Sb4,导电性差。此外还有灰色的无定形锑,黄色的黄锑,黑色的黑锑等。锑化学性质不很活动。室温下不能被空气中氧气氧化,但能跟氟、氯、溴化合生成三价或五价卤化物。加热时可跟碘、硫化合。高温时燃烧显蓝色并生成Sb4O6。常温时不跟水反应,红热时跟水反应放出氢气。跟热硝酸反应,生成水合氧化锑:
6Sb+10HNO3+3xH2O=3Sb2O5·xH2O+10NO↑+5H2O
能溶于热的浓盐酸和硫酸生成氯化锑和硫酸锑。与强碱反应生成亚锑酸盐,主要用于制合金如印刷用的活字合金、硬质合金、巴氏合金。还用于制锑盐、医药、颜料及半导体材料等。古代已应用锑及其化合物。在自然界中有游离态和化合态两种形式存在,主要矿物有辉锑矿(Sb2S3)和方锑矿(Sb2O3)。在地壳中的丰度为1.0×10-4%。用辉锑矿跟铁屑共热,或用三氧化二锑与碳共热都可还原出锑。
[三氯化锑]化学式SbCl3,式量228.11。无色正交晶体,密度3.140克/厘米3,熔点73.4℃,沸点283℃。潮解,易溶于水,并被水解为氯氧化锑SbOCl。常温下可溶于无水乙醇而不分解,可溶于盐酸。用于制造吐酒石、药物,还用于有机合成的催化剂。将锑跟氯气反应或将三氧化二锑跟氯化氢气体反应制得。
[铋]元素符号Bi,原子序数83,原子量208.98,外围电子排布6s26p3,位于第六周期第ⅤA族,共价半径152皮米,离子半径Bi3+120皮米,Bi5+74皮米,第一电离能703.3千焦/摩尔,电负性1.9。银白色或微红色有金属光泽的晶体,熔点271.4℃,沸点1560±5℃,蒸气分子中单原子分子和双原子分子处于平衡状态。主要氧化数-3、+1、+3、+5。质脆而硬,凝固时体积膨胀,膨胀率为3.3%。密度9.747克/厘米3。常温下在干燥空气中稳定,在潮湿空气中可被氧化。红热时燃烧呈蓝色火焰,生成黄色氧化物Bi2O3。常温下不跟水反应,红热时能被水蒸气缓慢氧化。铋粉可在氯气中自燃,加热时跟溴、碘、硫、硒直接化合生成三价化合物。不溶于稀盐酸和稀硫酸,溶于硝酸和浓硫酸生成三价铋盐。1753年英吉甫鲁瓦发现了铋。自然界中有游离态和化合态两种形式。主要矿物有辉铋矿、铋华等。在地壳中的丰度为2.0×10-5%。主要用于制低熔点合金(熔点在45℃以上100℃以下),在消防和电气工业上用作自动灭火装置和保险丝及焊锡。还用于制活字合金、医药等。由煅烧辉铋矿得三氧化二铋,再与碳共热还原得到铋。
[碳]元素符号C,原子序数6,原子量12.01,外围电子层排布2s22p2,位于第二周期第ⅣA族,主要氧化数有+4、+2、-4、(-2),共价半径为77皮米,离子半径(C4+)16皮米,第一电离能1086.1千焦/摩尔,电负性2.5。有碳-12和碳-14两种稳定的同位素,碳-14具有放射性。碳原子的价电子数目与价电子轨道数相等,是等电子原子,可以用sp、sp2、和sp3杂化轨道形成4个σ键、碳原子半径小,还能形成p-pπ键,所以碳能形成多重键(双键或叁键),碳原子自相结合成键的能力很强,所以碳的化合物特别多。在自然界分布很广,石墨、煤、石油、天然气、石灰石、动植物体中都含碳元素。地壳中碳占总质量的0.032%。碳有三种同素异形体:金刚石、石墨和无定形碳(如木炭、焦炭、炭焦等,由石墨微晶体构成)。碳的物理性质和化学活动性跟其晶体结构有密切关系。金刚石为典型原子晶体,不导电,硬度最大,密度3.51克/厘米3,熔点3550℃,沸点4827℃;石墨质软,灰黑色,密度2.25克/厘米3,熔点 3652℃,有良好传热和导电性。碳化学性质稳定,常温下不跟空气中的氧气反应,不溶于水,稀碱和有机溶剂中。在高温时,碳燃烧生成一氧化碳或二氧化碳。卤素中只有氟跟碳反应。跟硫在高温下生成二硫化碳。红热的碳跟水蒸气反应生成水煤气(CO和H2)。高温时可跟许多金属反应生成金属碳化物。高温时有强还原性,可将一些金属或非金属从氧化中还原出来。可被热浓硫酸或热浓硝酸氧化成二氧化碳。碳有广泛的用途,是钢铁和某些其他合金的重要组成部分,是冶金工业、化学工业的重要原料。碳在古代就被发现。裂解天然气(主要成分是甲烷)可得到纯净的碳。
[金刚石]是碳的一种同素异形体,典型的原子晶体。碳原子形成4个sp3杂化轨道,以共价键彼此相连,每个碳原子都处于与它相联的四个碳原子所组成的正四面体的中心,组成了晶体,整个晶体可以看成是一巨型分子。晶体属等轴晶系,常为八面体晶形。纯品无色透明、有强烈光泽,因含杂质呈蓝色、天蓝色、淡黄色、红色或黑色。密度3.15-3.53克/厘米3,熔点3550℃,沸点4827℃,硬度10,是最硬的物质。不导电。在紫外线下显淡青蓝色荧光。与各种化学试剂不起反应,777℃时能在氧气中燃烧生成二氧化碳。用作高级的研磨、钻孔、切割、拉丝工具。透明的经过琢磨称为钻石,是一种华贵的装饰品。自然界有少量金刚石矿。用人工方法可制造金刚石,如石墨在高温高压和催化剂作用下可转化成金刚石。
[石墨]是碳的一种同素异形体,是原子晶体、金属晶体和分子晶体之间的一种过渡型晶体。在晶体中同层碳原子间以sp2杂化形成共价键,每个碳原子与另外三个碳原子相联,六个碳原子在同一平面上形成正六边形的环,伸展形成片层结构。在同一平面的碳原子还各剩下一个p轨道,它们互相重叠,形成离域的π键电子在晶格中能自由移动,可以被激发,所以石墨有金属光泽,能导电、传热。由于层与层间距离大,结合力(范德华力)小,各层可以滑动,所以石墨的密度比金刚石小,质软并有滑腻感。灰黑,不透明固体,密度2.25克/厘米3,熔点3652℃,沸点4827℃,硬度1。化学性质稳定,耐腐蚀,同酸、碱等药剂不易发生反应。687℃在氧气中燃烧生成二氧化碳。可被强氧化剂如浓硝酸、高锰酸钾等氧化。可用作抗磨剂、润滑剂,高纯度石墨用作原子反应堆中的中子减速剂,还可用于制造坩埚、电极、电刷、干电池、石墨纤维、换热器、冷却器、电弧炉、弧光灯、铅笔的笔芯等。
[活性炭]是一种黑色粉状,粒状或丸状的无定形具有多孔的碳,也具有石墨那样的精细结构,只是晶粒较小,层层间不规则堆积。具有较大的表面积(500-1000米2/克),有很强的吸附性能,能在它的表面上吸附气体、液体或胶态固体;对于气体、液体,吸附物质的质量可接近于活性炭本身的质量。其吸附作用具有选择性,非极性物质比极性物质更易于吸附。在同一系列物质中,沸点越高的物质越容易被吸附,压强越大温度越低浓度越大,吸附量越大。反之,减压,升温有利于气体的解吸。常用于气体的吸附、分离和提纯,溶剂的回收,糖液、油脂、甘油、药物的脱色剂,饮用水及冰箱的除臭剂,防毒面具中的滤毒剂,还可用作催化剂或金属盐催化剂的载体。可用木材、泥炭、坚果壳等为原料,经干馏、活化处理后得到活性碳。
[焦炭]干馏煤或石油沥青后得到的固体产物。呈银白色或灰黑色光泽。坚硬多孔,热值为25000-31400千焦/千克。根据原料、干馏温度和用途的不同,可分为高温焦、中温焦、低温焦、冶金焦、煤气焦、石油焦等。焦炭燃烧时无烟、有较强的抗压强度,是一种非常好的还原剂。用于生铁和其它金属的冶炼,还用于制造电石、半水煤气。是一种重要的化工原料。
[炭黑]黑色质轻且细的无定形碳粉末。密度1.8-2.1克/厘米3。不溶于各种溶剂。根据不同原料得到的炭黑分别称为乙炔黑、灯黑、混气炭黑、气黑等。按产品性能可分为:高耐磨炭黑、导电炭黑、补强炭黑等。主要用作橡胶的补强剂,也用于黑色颜料、油漆、油墨的制造。将天然气、重油、焦油产品高温裂解或进行不完全燃烧制得。
[二氧化碳]化学式CO2,式量44.01。俗名碳酸气,也称碳酸酐或碳酐。为无色略有酸味的气体。密度为1.977克/升,熔点-56.6℃(226.89千帕--5.2大气压),沸点-78.5℃(升华)。临界温度31.1℃。常温下7092.75千帕(70大气压)液化成无色液体。液体二氧化碳密度1.1克/厘米3。液体二氧化碳蒸发时或在加压冷却时可凝成固体二氧化碳,俗称干冰,是一种低温致冷剂,密度为1.56克/厘米3。二氧化碳能溶于水,20℃时每100体积水可溶88体积二氧化碳,一部分跟水反应生成碳酸。化学性质稳定,没有可燃性,一般不支持燃烧,但活泼金属可在二氧化碳中燃烧,如点燃的镁条可在二氧化碳中燃烧生成氧化镁和碳。二氧化碳是酸性氧化物,可跟碱或碱性氧化物反应生成碳酸盐。跟氨水反应生成碳酸氢铵。无毒、但空气中二氧化碳含量过高时,也会使人因缺氧而发生窒息。绿色植物能将二氧化碳跟水在光合作用下合成有机物。二氧化碳可用于制造碳酸氢铵、小苏打、纯碱、尿素、铅白颜料、饮料、灭火器以及铸钢件的淬火。二氧化碳在大气中约占总体积的0.03%,人呼出的气体中二氧化碳约占4%。实验室中常用盐酸跟大理石反应制取二氧化碳,工业上用煅烧石灰石或酿酒的发酵气中来获得二氧化碳。
[一氧化碳]化学式CO,式量28.01。一氧化碳分子有十个价电子,是等电子体,分子中有三重键,一个σ键、两个π键,其中一个π键为配位键,这对电子来自氧原子。一氧化碳是无色无臭气体,密度1.25克/升,熔点-199℃,沸点-191.5℃,微溶于水。在空气中燃烧时呈蓝色火焰并生成二氧化碳,若跟空气或氧气混和点燃时容易发生爆炸。有还原性,在高温下、是一种很好的还原剂,能还原许多金属氧化物(如氧化铁、氧化铜、二氧化锰等)。加热时跟碱反应生成甲酸盐。
NaOH+CO=HCOONa
跟硫、氯反应分别生成硫氧化碳COS或光气COCl2。能跟过渡金属形成羰基络合物Fe(CO)5、Ni(CO)4、和Cr(CO)6等。工业上常用亚铜盐的氨水溶液来吸收混和气体中的一氧化碳
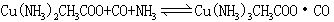
CO有毒,人吸入少量会感到头痛,吸入多量会因缺氧致死,这是因为一氧化碳跟血红蛋白形成稳定的络合物,(一氧化碳跟血红蛋白的亲和力是氧跟血红蛋白亲和力的230-270倍)使血红蛋白丧失了输氧能力,即煤气中毒。空气中只要有八百分之一体积的一氧化碳,就可使人在半小时内死亡。一氧化碳用作气体燃料,冶金工业中用作还原剂,化学工业中用做有机合成的原料。实验室中用甲酸或草酸跟浓硫酸反应制取,工业上将用有限空气通过灼热的碳或将水蒸气通过灼热的碳来制取。
[二硫化碳]化学式CS2,式量76.14。纯品为无色液体,工业品含杂质者呈黄色,有臭味,有毒。密度1.26克/厘米3,熔点-108.6℃,沸点46.3℃。不溶于水,易溶于乙醇、乙醚、苯、四氯化碳。二硫化碳是良好的溶剂、能使白磷、硫、碘、蜡、树脂、樟脑溶解,能溶于苛性碱和硫化碱溶液中。用作油脂、蜡、橡胶、硫、树脂的溶剂,羊毛的脱脂剂,农作物的杀虫剂,衣物的去渍剂。可用硫蒸气跟红热的碳反应制得。
[干冰]化学式CO2,固态二氧化碳的俗称。白色冰雪状固体,分子型晶体。无毒无腐蚀性,密度1.56克/厘米3(-79℃)、熔点-56.6℃(226.89千帕--5.2大气压)。受热后,在-78.5℃时不经过液态直接变成气体(升华)。常压下气化时可得-80℃左右的低温,减压蒸发可得更低的温度。用作低温致冷剂,用于冷冻食品的运输箱、冷藏卡车。与乙醚、氯仿或丙酮等有机溶剂组成的冷膏在施工中用于低温冷浴,还可用于人工降雨、灭火和制汽水等。使液态二氧化碳减压膨胀可制得干冰。
[硅]元素符号Si,原子序数14,原子量28.086,外围电子排布3s23p2,位于第三周期第ⅣA族,共价半径117皮米,离子半径42皮米,第一电离能786.1千焦/摩尔,电负性1.8。有晶体和无定形两种同素异形体。晶体硅呈银灰色,有明显的金属光泽、晶格和金刚石相同,硬而脆,能导电,但导电率不如金属且随温度的升高而增加,属半导体。密度2.33克/厘米3,熔点1410℃,沸点2355℃,硬度7。低温时单质硅不活泼,不跟空气、水和酸反应。室温下表面被氧化形成1000皮米二氧化硅保护膜。高温时能跟所有卤素反应,生成四卤化硅,跟氧气在700℃以上时燃烧生成二氧化硅。跟氯化氢气在500℃时反应,生成三氯氢硅SiHCl3和氢气。高温下能跟某些金属(镁、钙、铁、铂等)反应,生成硅化物,如:
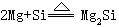
赤热时跟水蒸气反应生成二氧化硅和氢气。跟强碱溶液反应生成硅酸盐放出氢气。跟氢氟酸反应生成四氟化硅。用于制造合金如高硅铸铁、硅钢等,还用于制造有机硅化合物如硅酮树脂、硅油和硅橡胶等。高纯度的单晶硅是半导体材料;掺有微量杂质的单晶硅可用于制造晶体管、整流器和太阳能电池等,广泛应用于电子工业。1823年瑞典的贝采利乌斯用氟化硅或氟硅酸钾与钾共热得到粉状硅,并确定其为元素。从前叫矽(音西),因同音元素较多,我国化学界于1953年把矽改称硅。硅在自然界分布很广,在地壳中硅原子的含量为16.7%,质量百分含量为27.6%,自然界的硅由硅-28、硅-29、硅-30三种稳定同位素组成,硅是组成岩石矿物的一种基本元素,主要以石英砂或硅酸盐的形式存在。工业上用碳在电炉内还原二氧化硅制得粗硅。用氢气还原三氯氢硅或四氯化硅可制得高纯度硅。
[单晶硅]硅的单晶体。具有基本完整的点阵结构的晶体。不同的方向具有不同的性质,是一种良好的半导材料。纯度要求达到99.9999%,甚至达到99.9999999%以上。用于制造半导体器件、太阳能电池等。用高纯度的多晶硅在单晶炉内拉制而成。
[二氧化硅]化学式SiO2,式量60.08。也叫硅石,是一种坚硬难溶的固体。从地面往下16千米几乎65%为二氧化硅的矿石。天然的二氧化硅分为晶态和无定形两大类,晶态二氧化硅主要存在于石英矿中。纯石英为无色晶体,大而透明的棱柱状石英为水晶。二氧化硅是硅原子跟四个氧原子形成的四面体结构的原子晶体,整个晶体可看作是一个巨大分子,SiO2是最简式,并不表示单个分子。密度2.32克/厘米3,熔点1723±5℃,沸点2230℃。无定形二氧化硅为白色固体或粉末。化学性质很稳定。不溶于水也不跟水反应。是酸性氧化物,不跟一般酸反应。气态氟化氢或氢氟酸跟二氧化硅反应生成气态四氟化硅。跟热的强碱溶液或熔化的碱反应生成硅酸盐和水。跟多种金属氧化物在高温下反应生成硅酸盐。用于制造石英玻璃、光学仪器、化学器皿、普通玻璃、耐火材料、光导纤维,陶瓷等。
[石英]矿物名。主要化学成分为SiO2,三方晶系,晶体呈六方柱状。常呈晶簇状、粒状、块状等单体或群体。颜色不一,无色透明的晶体称水晶,乳白色的称乳石英,紫色的称紫水晶,烟黄褐色的称烟晶、茶晶,黑色的称墨晶,晶体中含有白色或其它颜色放射状物的称金星石。玻璃光泽,无解理,贝壳状断口,硬度7,密度2.65-2.66克/厘米3。纯净的石英能让一定波长范围的紫外线、可见光和红外线透过。具有旋光性、压电和电致伸缩性质。石英的完整晶体产于岩石晶洞中,块状的常产于热液矿脉中,也是花岗岩、片麻岩和砂岩等各种岩石的重要组成部分。石英晶体也可以用人工方法制成。
结晶良好的晶体可用作光学仪器和压电材料;其它各种形态的石英变种可用于制造玻璃、搪瓷及研磨材料和建筑材料等。
[水晶]见石英条。
[压电石英]石英的变种之一。指能用于电子工业制造石英钟、高频振荡器、滤波器等压电石英片的纯洁石英。这种石英晶体必须无色透明,不含杂质和裂隙、并且不具双晶。
[石英玻璃]由二氧化硅组成的玻璃。这种玻璃硬度大可达莫氏七级,膨胀系数低,耐热性、化学稳定性、电绝缘性都比较好,除氢氟酸、热磷酸外,对一般酸有较好的耐酸性。透明的石英玻璃有良好的透紫外线性能和光学性能。用于制造光学仪器、电学设备、医疗设备和耐高温耐腐蚀的化学仪器。高纯石英玻璃可制光导纤维。
[四氟化硅]化学式SiF4,式量104.09。无色气体,有窒息性气味、密度4.67克/升,熔点-90.2℃,沸点-86℃。在潮湿空气中水解发烟,遇水水解,生成原硅酸H4SiO4和氢氟酸,水解生成的氢氟酸跟未水解的四氟化硅络合生成氟硅酸。能溶于硝酸和乙醇。用于化学分析,制备氟硅酸。用浓硫酸、氟化钙及二氧化硅混合加热可得本品。也是硫酸跟氟磷酸钙制磷肥的副产物。
[氟硅酸]化学式H2SiF6,式量144.12,无水氟硅酸为无色气体,化学性质不稳定,常温下易分解为四氟化硅和氟化氢。水溶液显强酸性,一般能制得60%的水溶液,酸的强度跟硫酸相当、浓溶液冷却,有无色含水氟硅酸析出。具有消毒性能,可作啤酒酿造中的消毒剂。由四氟化硅跟氟化氢直接反应制得,也可将二氧化硅溶解于氢氟酸中制得。
[硅酸]原称偏硅酸,化学式H2SiO3,式量78.10。白色无定形粉末,不溶于水。是一种二元弱酸,电离平衡常数K1=2×10-10(室温)。不溶于盐酸、硫酸,溶于氢氟酸。溶于氢氧化钾或氢氧化钠溶液,生成硅酸钾K2SiO3或硅酸钠Na2SiO3和水。熔点为150℃(分解)。加热到150℃以上时分解为二氧化硅和水,二氧化硅是硅酸酐。用做气体和蒸气的吸收剂、催化剂或做其它催化剂的载体。由于二氧化硅不跟水化合,所以硅酸主要通过硅酸盐溶液跟强酸反应制得。
[硅胶]化学式SiO2·xH2O或mSiO2·nH2O,也称氧化硅胶或硅酸凝胶。硅胶成无色透明或乳白色颗粒。通常含水分约3-7%。具有多孔结构。有较强的吸附性,吸湿量能达到40%左右。主要用于气体干燥、气体吸收、液体脱水,催化剂、催化剂载体以及用作气相色谱分析试剂、薄层色谱分析试剂、柱式色谱填料。为了表示吸水程度的大小,市场出售的变色硅胶是将硅酸凝胶用氯化钴溶液浸泡、干燥活化后制得的一种干燥剂。用硅酸钠溶液(水玻璃)跟盐酸或稀硫酸反应,经胶凝、洗涤、干燥、烘干制成。
[四氯化硅]化学式SiCl4,式量169.9,无色发烟液体。密度1.483克/厘米3(液),熔点-70℃,沸点57.57℃。在水中水解;在潮湿空气中水解,生成硅酸和氯化氢,并形成白雾。能溶于四氯化锡、四氯化碳。对皮肤有腐蚀性。高温时可被氢气还原生成硅和氯化氢。主要用于制造硅酸树脂、有机硅单体、有机硅油、高温绝缘漆、硅树酯和硅橡胶等,也用它作烟雾剂。将粗硅跟氯气反应,再经蒸馏制得。
[碳化硅]化学式SiC,俗称金刚砂。纯品为无色晶体,属原子晶体,一般因含杂质而呈暗黑色。硬度9,仅次于金刚石,密度2.317克/厘米3,熔点约2700℃(升华并开始分解)。难溶于水和酸。可用于制砂轮、磨石、砂布、研磨粉、耐火材料等。碳化硅单晶可制电子器件。将石英砂、焦炭在电炉中强热可制得。
[金刚砂]狭义指碳化硅,广义是用作磨料的金刚石、石榴石、碳化硅及刚玉的统称。
[硅烷]硅原子跟碳原子结构相似,可跟氢组成一系列硅氢化合物。硅氢化合物总称为硅烷,通式是SinH2n+2,目前已制得的有一硅烷SiH4也叫甲硅烷到六硅烷Si6H14共六种。
甲硅烷:SiH4,无色无臭气体、密度1.44克/升,熔点-185℃,沸点-111.8℃,不溶于水。
乙硅烷:Si2H6,无色无臭气体,密度2.87克/升,熔点-132.5℃,沸点-14.5℃,微水解。
其它硅烷是液体。硅烷都能溶于有机溶剂,如乙醇、苯、二硫化碳等。硅烷比烷烃化学性质活泼。所有硅烷热稳定性都很差。将高硅烷适当加热,分解为低硅烷。低硅烷(如SiH4)在温度高于500℃时分解为硅和氢气。有强还原性。在空气中能自燃,生成二氧化硅和水,并放出大量的热,可被一般氧化剂氧化,如:
SiH4+2KMnO4=2MnO2↓+K2SiO3+H2↑+H2O
室温下跟卤素发生爆炸性的反应。在强碱溶液中水解为硅酸盐和氢气。在卤化铝催化作用下,跟干燥的卤化氢反应,生成卤硅烷。用硅化镁跟盐酸反应,立即有气体放出,这种气体为硅烷的混合物,其中大部分为甲硅烷。还可用硅化镁跟溴化铵在液氨中反应制得。混合气体经液化后再分馏,得到不同硅烷。
[锗]元素符号Ge,原子序数32,原子量72.59,外围电子排布式4s24p2,原子半径122皮米,Ge4+半径53皮米,第一电离能769.12千焦/摩尔,电负性1.8,主要氧化数为+4、+2。位于第四周期ⅣA族。银白色有光泽金属,质脆,晶体锗具有金刚石结构,密度5.35克/厘米3,熔点937.4℃,沸点2830℃。室温下在空气中较稳定,在高温下能被氧化。粉状锗可在氯或溴中燃烧。不溶于水和盐酸及稀硫酸。能溶于浓硝酸、浓硫酸或王水。不溶于稀苛性碱溶液;可溶于熔融的苛性碱、硝酸盐或碳酸盐,生成锗酸盐。能跟硫化合生成硫化锗。在1000℃以上可跟氢化合。高纯度锗是半导体材料,掺有微量特定杂质的锗单晶可用于制各种晶体管、整流器及其他器件,作为温差电池材料用于制太阳能电池、光电池,用于制热敏电阻、薄膜电阻、半导体温度计、专门透过红外线的锗窗、棱镜或透镜等。锗的化合物用于制荧光板及各种高折光率玻璃。锗属于稀散元素,没有可供工业开采的矿石,在地壳中占质量的7.0×10-4,在煤、银、锡、锌、铜等矿中含有少量。近代工业生产主要以硫化锌矿、煤以及冶金废料或烟道灰尘中回收。门捷列夫于1871年曾预言其存在,十四年后德国化学家文克勒于1885年在分析硫银锗矿时发现了锗,后由硫化锗与氢共热,制出了锗。提炼锗的原理是先将硫化物矿氧化,使矿石中的硫化锗转化为二氧化锗,再用盐酸溶解并蒸馏,利用四氯化锗的挥发性将它分离出来。再将四氯化锗水解,使其转变为二氧化锗,然后在低于540℃的温度用氢气还原氧化锗
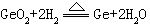
[二氧化锗]化学式GeO2,式量104.59。白色粉末不溶于水,不跟水反应。是以酸性为主的两性氧化物。可溶于浓盐酸生成四氯化锗,也可溶于强碱溶液,生成锗酸盐,如:
GeO2+2NaOH=Na2GeO3+H2O
用作半导体材料。由锗加热氧化或由四氯化锗水解制得。
[四氯化锗]化学式GeCl4,式量214.43。无色液体,能与硫酸混溶,遇水分解生成二氧化锗。密度1.879克/厘米3,熔点-49.5℃,沸点83.1℃。制半导体锗的原料。由浓盐酸溶解二氧化锗制得。
[锡]元素符号Sn,原子序数50,原子量118.7,外围电子排布5s25p2,位于第五周期ⅣA族,原子半径140皮米,Sn4+半径71皮米,第一电离能714.78千焦/摩尔,电负性1.8。锡有三种同素异形体:灰锡(α体)、白锡(β体)、脆锡(γ体),其转化温度为:
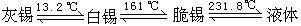
白锡是银白色金属,有延展性,密度7.31克/厘米3,熔点231.88℃,沸点2270℃。平常的白锡为金刚石晶型,可在13.2℃时极缓慢地转变成灰锡,当温度远低于零度时才有明显变化,而在-48℃时变得最快,变为灰锡时锡制品完全毁坏,毁坏先在某点开始,迅速蔓延开,故称为锡疫。灰锡为四方晶体,密度为5.75克/厘米3。白锡在161℃时转变为脆锡,脆锡为正交晶体,密度为6.52-6.56克/厘米3。锡在空气中可形成致密氧化物保护膜,阻止进一步氧化。高温时锡在空气中燃烧发白光生成二氧化锡。常温下不跟水反应,红热时跟水反应。可跟卤素和硫化合,如氯气跟熔融锡化合生无色液体四氯化锡。与稀盐酸反应慢,跟热浓盐酸反应快,生成二氯化锡和氢气。与稀硫酸难反应,跟热浓硫酸反应生成硫酸锡。
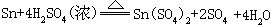
跟冷稀硝酸反应生成Sn(NO3)2:
4Sn+10HNO3(稀)=4Sn(NO3)2+NH4NO3+3H2O
跟浓硝酸反应生成白色沉淀β锡酸。
Sn+4HNO3(浓)=H2SnO3↓+4NO2↑+H2O
与强碱溶液反应生成锡酸钠并放出氢气
Sn+2NaOH+H2O=2H2↑+Na2SnO3
锡用于制各种合金如青铜、焊锡合金、巴氏合金、铅字合金等。由于锡和锡的无机盐无毒,用于制贮存食品的镀锡容器,镀锡铁片叫马口铁,还应用电镀、陶瓷和塑料工业。锡在古代是人类最早应用于生产和生活的金属之一。在地壳中占质量的0.004%。主要的矿物是锡石SnO2。将锡石经选矿后,用碳还原制得粗锡,然后用电解法或加热重熔精制。
[一氧化锡]又名氧化亚锡,化学式SnO,式量134.7。暗灰或棕黑色粉末。在空气中稳定,加热时转化为氧化锡(二氧化锡),不溶于水和醇。溶于盐酸或稀硫酸生成亚锡盐,溶于浓的强碱溶液生成亚锡酸盐。有还原性。用作还原剂,制备亚锡盐,还用于电镀和玻璃工业。由亚锡盐溶液跟氢氧化钠溶液反应生成氢氧化亚锡Sn(OH)2,再加热分解生成氧化亚锡。
[二氧化锡]又名氧化锡,化学式SnO2,式量150.7。白色,四方、六方或正交晶体,密度为6.95克/厘米3,熔点1630℃,于1800-1900℃升华。难溶于水、醇、稀酸和碱液。缓溶于热浓强碱溶液并分解,与强碱共熔可生成锡酸盐。能溶于浓硫酸或浓盐酸。用于制锡盐、催化剂、媒染剂,配制涂料,玻璃、搪瓷工业用作抛光剂。锡在空气中灼烧或将Sn(OH)4加热分解可制得。
[氯化亚锡]化学式SnCl2,式量189.6,又名二氯化锡。白色结晶,溶于水、醇、丙酮、乙醚。熔点246℃。易水解生成Sn(OH)Cl,为防水解,先将固体SnCl2溶于浓盐酸,再加水稀释。有较强的还原性,可将汞盐还原为亚汞盐或金属汞。用作还原剂、媒染剂以及用于银、砷、钼、汞的测定。用锡跟浓盐酸或用一氧化锡跟盐酸反应可制得。
[氯化锡]又名四氯化锡,化学式SnCl4,式量260.53。无色发烟液体,呈碱性,溶于水并放出大量热,其稀水溶液因水解而产生锡酸沉淀。能与醇、二硫化碳和松节油任意混溶。对氯气的吸收量很大。密度2.23克/厘米3,熔点-33℃,沸点114℃,有腐蚀性,有毒。用于有机锡制备。有机分析中用以皂化酚和醚,由铷和钯中分离钾。其水合物为SnCl4·5H2O,白色或浅黄色固体,吸湿性强,易溶于水。用于有机合成、媒染剂、电子工业由锡跟干燥氯反应制得。
[锡酸钠]化学式Na2SnO3·3H2O,式量266.74。无色六方晶体或白色粉末。140℃失去三个结晶水。在空气中易吸收水分和二氧化碳生成氢氧化锡和碳酸钠。溶于水、不溶于醇。用作纺织品的防火剂、增重剂和媒染剂,还用于玻璃、陶瓷制造工业。由锡与氢氧化钠共熔,或由二氧化锡跟氢氧化钠溶液反应制得。
[铅]元素符号Pb,原子序数82,原子量207.2,外围电子排布6s26p2,位于第六周期ⅣA族,原子半径146皮米,Pb4+半径84皮米,第一电离能718.96千焦/摩尔,电负性1.8,主要氧化数+2、+4。银灰色有光泽的重金属,在空气中易氧化而失去光泽,变灰暗,质柔软,延性弱,展性强。密度11.34克/厘米3,熔点327.5℃,沸点1740℃。有较强的抗放射性穿透的性能。有毒。在常温下在空气中,铅表面易生成一层氧化铅或碱式碳酸铅,使铅失去光泽且防止进一步氧化。不溶于水。易和卤素、硫化合,生成PbCl4、PbI2、PbS等。熔融的铅跟空气反应生成一氧化铅,将铅在纯氧中加热可得二氧化铅。与盐酸反应放出氢气并生成微溶性的PbCl2,覆盖在铅表面,使反应中止。与热浓盐酸反应生成HPbCl3、和H2。与稀硫酸反应放出氢并生成难溶的PbSO4覆盖层,使反应中止。但易溶于热的浓硫酸生成Pb(HSO4)2并放出SO4。跟稀硝酸或浓硝酸反应都可生成硝酸铅Pb(NO3)2。在有氧存在的条件下可溶于醋酸等有机酸,生成可溶性的铅盐。跟强碱溶液缓慢的反应放出氢气生成亚铅酸盐,如:
Ph+2NaOH=Na2PbO3+H2↑
在有氧气条件下跟水反应生成难溶的Pb(OH)2。铅早在公元前三千年左右就被人类发现并应用。在地壳中质量百分比为0.0016%。主要存在于方铅矿(PbS),白铅矿(PbCO3)中。用作电缆,蓄电池、铸字合金、巴氏合金、金属结构的阴极保护层、防X射线等辐射的材料。用焦炭还原氧化铅制得。
[一氧化铅]又称黄色氧化铅,俗名黄丹或密陀僧。化学式PbO,式量223.19。有多种变体,四方晶体呈黄红色,密度为9.53克/厘米3;斜方正交晶体呈黄色,密度为8.0克/厘米3;无定形者为黄色到红黄色,密度9.2-9.5克/厘米3。熔点888℃。难溶于水和乙醇。溶于硝酸、醋酸生成相应的铅盐。溶于热的强碱溶液生成亚铅酸盐。吸收空气中二氧化碳生成碳酸铅。在空气中加热至500℃可生成四氧化三铅。加热时可被碳、氢气、一氧化碳还原成铅。与甘油混和生成坚硬的物质、可用作粘合剂。用作颜料、涂料油漆的催干剂、冶金助熔剂,还用于制特种铅玻璃、搪瓷、蓄电池电极、橡胶。用空气氧化熔融铅或加热碳酸铅、硝酸铅分解制得。
[二氧化铅]又称棕色氧化铅。化学式PbO2,式量239.19,棕色细片粉末。密度9.375克/厘米3,难溶于水和乙醇。将二氧化铅加热,它会逐步转变为铅的低氧化态氧化物并放出氧
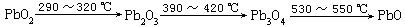
二氧化铅系两性氧化物,酸性比碱性强。跟强碱共热生成铅酸盐。有强氧化性。跟硫酸共热生成硫酸铅、氧气和水。跟盐酸共热,生成二氯化铅、氯气和水。跟硫、磷等可燃物混和研磨引起发火。用作分析试剂、氧化剂、媒染剂、蓄电池电极,还用于制火柴、染料等。用熔融的氯酸钾或硝酸盐氧化一氧化铅,或用次氯酸钠氧化亚铅酸盐可制得二氧化铅。
[四氧化三铅]俗称红丹或铅丹,红色氧化铅。化学式Pb3O4,式量685.57。橙红色晶体或粉末,密度9.1克/厘米3,不溶于水和醇。四氧化三铅中,有2/3的铅氧化数为+2,1/3的铅氧化数为+4,化学式可写作2PbO·PbO2。根据结构应属于铅酸二价铅盐(Pb2[PbO4])。在加热至500℃以上时分解为一氧化铅和氧气。不溶于水。可溶于热碱溶液中。有氧化性,跟盐酸反应放出氯气;跟硫酸反应放出氧气。可被稀硝酸分解,其中2/3的铅被酸溶解,生成硝酸铅(Ⅱ),其它为不溶的二氧化铅。一氧化铅有碱性,溶于稀硝酸,二氧化铅呈弱碱性,稍溶于酸。有毒。用于制铅玻璃、油漆、蓄电池、陶瓷、搪瓷。还用于制钢铁涂料。将一氧化铅粉末在空气中加热至450-500℃氧化制得。
[硝酸铅]化学式Pb(NO3)2,式量331.21。无色单斜或立方晶体。密度4.53克/厘米3。溶于水,微溶于醇。在470℃时分解为一氧化铅、二氧化氮和氧气。有强氧化性,与有机物接触、摩擦或撞击能引起燃烧或爆炸。有剧毒。用作氧化剂、媒染剂、照像增感剂、分析试剂、制版等。由铅跟硝酸反应制得。
[醋酸铅]亦称乙酸铅,俗称铅糖。无色晶体或白色粉末,化学式(CH3COO)2Pb·3H2O,式量379.33,密度2.55克/厘米3。75℃失去结晶水,无水物是白色粉末,密度3.25克/厘米3,熔点280℃。味甜,有毒!易溶于水和甘油,微溶于乙醇。具有醋酸气味。在空气中吸收二氧化碳后变为不溶性的碱式碳酸盐。在100℃时分解出乙酸,在200℃时完全分解。用作分析试剂、媒染剂、染发剂、医药、生物染色、有机合成,还用于制铬酸铅颜料等。由铅粒跟醋酸反应制得。
[硫化铅]化学式PbS,式量239.25,蓝色有金属光泽立方晶体或棕黑色粉末。密度7.5克/厘米3,熔点1114℃,在860℃时开始挥发,难溶于水和碱溶液。可溶于硝酸。在空气中灼烧,可生成一氧化铅和二氧化硫。自然界中主要矿石为方铅矿,是炼铅的原料。高纯度的硫化铅用作半导体。将硫化氢通入酸性硝酸铅溶液可制得。
[铬酸铅]俗名铬黄,化学式PbCrO4,式量323.18。黄色或橙黄色针状晶体或粉末,密度6.12克/厘米3,熔点844℃。难溶于水,溶于强碱溶液或硝酸。有毒。加热到熔点以上,缓慢分解放出氧气。用作分析试剂、氧化剂、黄色颜料。由铬酸钾溶液跟硝酸铅溶液反应制得。
[密陀僧]见一氧化铅条。
[黄丹]见一氧化铅条。
[红丹]见四氧化三铅条。
[铅丹]矿物名,主要成分是Pb3O4,红色粉末状块体。硬度2-3,密度4.6克/厘米3,常与方铅矿和白铅矿伴生。用于制红色颜料和铅玻璃。通常用的红丹即铅丹,大部分由人工制成。
[方铅矿]主要成分为PbS,常含银。等轴晶系,晶体形状多为立方体、有时为八面体。铅灰色,有金属光泽,立方体解理完全,硬度2-3,性脆,密度7.4-7.6克/厘米3。炼铅的主要矿石,由于常含银,又是炼银的主要矿石。
[锡石]矿物名。化学成分为SnO2,四方晶系,晶体一般为双锥状,双锥柱状,常具膝状双晶,集合体呈不规则颗粒。通常呈棕色至黑褐色,有金刚光泽。硬度6.0-7.0,密度6.8-7.0克/厘米3。是炼锡的主要原料。
[白铅矿]主要成分是PbCO3。正交晶系,晶形常呈假六方双锥形状,集合体为粒状或致密块状。白色微带浅灰。金刚光泽,硬度3.0-3.5,密度6.4-6.6克/厘米3。炼铅用矿石。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com