
7.金属钠不仅跟氧气、水等无机物反应,还能跟酒精、醋酸等有机物反应。要研究金属钠跟酒精反应的性质以及它与水反应的异同点,下列研究方法中没有用到的是
A.实验法 B.观察法 C.分类法 D.比较法
6.下列有关化学实验的操作或说法中,正确的是 ( )
A.用有少量蒸馏水的锥形瓶装待测液进行中和滴定实验,对测定结果没有影响
B.在进行硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行4次
C.苯酚中滴加少量稀溴水出现三溴苯酚白色沉淀
D.检验溴乙烷中的溴元素时,将溴乙烷和氢氧化钠溶液混合加热后,需加硫酸酸化
5.当向蓝色的CuSO4溶液中逐滴加入氨水时,观察到首先生成蓝色沉淀,而后沉淀又逐渐溶解成为深蓝色的溶液,向深蓝色的溶液中通入SO2气体,又产成白色沉淀;将白色沉淀加入稀硫酸中,又生成红色粉末状固体和SO2气体,同时溶液呈蓝色,根据上述实验现象分析推测,下列描述正确的有
A.Cu2+和Ag+相似,能与NH3结合生成铜氨络离子
B.白色沉淀为+2价铜的某种亚硫酸盐,溶于H2SO4发生复分解反应
C.白色沉淀为+1价铜的某种亚硫酸盐,溶于H2SO4发生自身氧化还原反应
D.反应过程中消耗的SO2与生成的SO2的物质的量相等
4、实验①:向盛有0.1mol / LAgNO3溶液的试管中滴加0.1mol / L的NaCl溶液至不再有白色沉淀生成为止。取上层澄清溶液,逐滴加入饱和Na2S溶液。
实验②:向盛有0.1mol / LAgNO3溶液的试管中滴加饱和Na2S溶液至沉淀完全,取上层澄清溶液,逐滴加0.1mol / L的NaCl溶液。对上述实验结果的现象描述正确的是:
A.实验①有黑色沉淀,实验②有白色沉淀 B.实验①有黑色沉淀,实验②无沉淀
C.实验①无沉淀,实验②有白色沉淀 D.实验①和实验②都无沉淀
3、为证明CuSO4溶液显蓝色与Cu2+有关而与SO42-无关,某同学设计了下列实验,其中对实验目的没有意义的是:①、观察稀硫酸颜色 ②、观察无水硫酸铜粉末颜色
③、稀释CuSO4溶液,观察溶液蓝色变化
④、往CuSO4溶液中滴加少量NaOH溶液,生成蓝色沉淀,过滤,观察滤液颜色变化
⑤、往CuSO4溶液中滴加足量BaCl2溶液,生成白色沉淀,过滤,观察滤液颜色变化
A、①②④ B、②③④ C、②③⑤ D、①④⑤
2、对照实验是研究物质性质的一种重要方法,下列不是用来作对照实验的是:
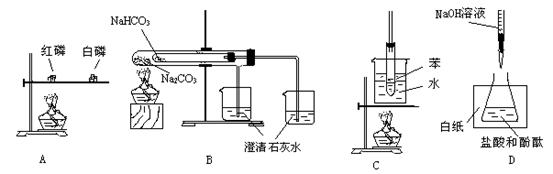
1.在实验室中从苯酚中分离出苯,可选用下列装置中的
|
A. B. C. D.
8.(10分) 硝酸铵在工农业生产中有重要作用,如做氮肥。
请回答下列问题:
(1)已知N2(g)
+ 3H2(g)  2NH3(g) ;ΔH=-92 kJ·mol-1。请回答:
2NH3(g) ;ΔH=-92 kJ·mol-1。请回答:
①在500℃、200atm和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量 92.4kJ (填“<”“>”或“=”)。
②为有效提高氢气的转化率,实际生产中宜采取的措施有 (填选项字母)
A.降低温度 B.最适合催化剂活性的适当高温 C.增大压强
D.降低压强 E.循环利用和不断补充氮气 F.及时移出氨
(2) 已知铂铑合金(Pt-Rh)网未预热也会发热。写出氨催化氧化的化学方程式:
该反应的化学平衡常数的表达式K= ,当温度升高时, K值 (增大、减小、无影响),其原因是 。
(3)将H2和N2按3:1的体积比混合于一定温度和压强的密闭容器中,当该反应达到平衡时,测得平衡混合气的平均式量为10,此时N2的转化率为 。
7.(10分)某化学研究小组以铜为电极电解饱和食盐水,探究过程如下:
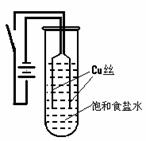 [实验1]:如右下图装置,电源接通后,与电池负极相连的铜丝上有大量气泡产生;与电池正极相连的铜丝由粗变细。电解开始30s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10。随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,溶液始终未出现蓝色。
[实验1]:如右下图装置,电源接通后,与电池负极相连的铜丝上有大量气泡产生;与电池正极相连的铜丝由粗变细。电解开始30s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10。随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,溶液始终未出现蓝色。
[实验2]:将实验1中试管底部的橙黄色沉淀取出,分装在两支小试管中,以后的操作和现象如下:
|
序号 |
操 作 |
现 象 |
|
① |
滴入稀硝酸溶液 |
沉淀溶解,有无色气泡产生,最终得到蓝色溶液。 |
|
② |
滴入稀硫酸溶液 |
橙黄色沉淀转变为紫红色不溶物,溶液呈现蓝色 |
[有关资料]常见铜的化合物颜色如下:
|
物质 |
颜
色 |
物质 |
颜 色 |
|
氯化铜 |
固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 |
氢氧化亚铜 (不稳定) |
橙黄色 |
|
碱式氯化铜 |
绿色 |
氢氧化铜 |
蓝色 |
|
氧化亚铜 |
砖红色或橙黄色 |
氯化亚铜 |
白色 |
请回答下列问题:
(1)铜的常见正化合价为 、 ,最终试管底部橙黄色沉淀的化学式
(2)阴极上发生的反应为:
阳极上发生的反应为:
(3)写出实验2中①、②的离子方程式
①
②
6.(15分)已知X、Y、Z、W是短周期元素中的四种非金属元素,它们的原子序数依次增大。X元素的原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
(1)请写出元素符号:Y Z W
(2)在一定条件下,由X单质与Z单质反应生成1molE放出的热量为46.2kJ,写出该反应的热化学方程式: ;E在催化剂存在的条件下,可用于还原汽车尾气中的 ,以减少对大气的污染。
(3)仅由X、Z、W三种元素组成的某种盐是一种速效化肥,但长期施用会使土壤酸化,有关的离子方程式为 ;由X、Y、Z、W四种元素可组成酸式盐,该化合物的水溶液与足量NaOH溶液在加热条件下反应的离子方程式为 。
(4)工业上可用E的浓溶液来检验输送氯气的管道是否漏气,若漏气时可观察到大量白烟,同时有单质Z生成,写出相应的化学方程式: 。该反应中被氧化的E与参与反应的E的质量之比为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com