
6、粗细和长度相同的一铜导线和一根铝导线串联在同一电路中,则:( ) A、两根导线上的电流一定相等 B、两根导线的电阻一定相等
C、铜导线上的电流大于铝导线上的电流 D、两根导线上的电流方向相反
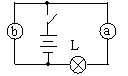



5、如图所示,向同一方向移动滑片,电阻的变化效果相同的是:( )

A、甲和丙 B、乙和丁 C、甲和丁 D、甲和乙
4、有两根粗细不同的导线,它们的横截面积之比为2:1,当把它们串联在电路中,有电流通过时,两根导线上电流的关系是:( )
A、I粗=2I细 B、2I粗=I细 C、I粗=I细 D、I粗=4I细
3、当温度一定时,比较两根铜导线电阻的大小,下列说法中正确的是:( )
A、长导线的电阻一定大 B、粗细相同,长导线的电阻一定大
C、细导线的电阻一定大 D、长度相同,粗导线的电阻一定大
2、下列说法中正确的是:( )
A、电流表与电压表都可以直接与电源相接
B、电流表可以直接与电源相接,而电压表不行
C、电流表与电压表都不可以直接与电源相接
D、电压表可以与电源直接相接,而电流表不能。
1、导体中的电流强度决定于:( ) A、通电时间的长度 B、导体的粗细和长短
C、导体中通过电量的多少 D、1秒内通过导体横截面电量的多少
20.已知:2Fe3++2I-===2Fe2++I2
2Fe2++Br2===2Fe3++2Br-
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是________,被氧化的离子的物质的量分别是________。
(2)如果向原溶液中通入3 mol Cl2,则被氧化的离子是________,其对应的氧化产物的物质的量分别是________。
(3)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c________(用含a、b的代数式表示)。
解析:由已知氧化还原反应方程式可知,微粒的还原性由强到弱的顺序为:I->Fe2+>Br-,当向含有FeI2和FeBr2的溶液中通入Cl2时,首先氧化I-,其次是Fe2+,然后是Br-,明确了这个顺序,再结合物质间反应的数量关系即可分析作答。
答案:(1)I-和Fe2+ 2 mol和2 mol (2)I-,Fe2+和Br- 1 mol、3 mol和0.5 mol (3)≥
19.化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol·L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好。(已知2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O)
(1)e处反应的离子方程式为________________________________________________。
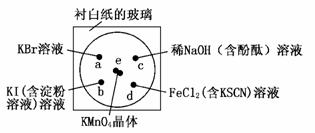
该反应中氧化剂和还原剂的物质的量之比为____________________________________。
(2)b处的实验现象:_______________ __________________________________。
d处的实验现象:________________ ________________________________________。
(3)C处反应的化学方程式为__________________________________________________。
标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为________mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?________(填“能”或“不能”),若能,其氧化性由强到弱的顺序是_ ____________________________。
 解析:(1)根据e处发生反应的化学方程式判断反应中的氧化剂为KMnO4,还原剂为HCl,其中氧化剂和还原剂的物质的量之比为2:10=1:5,而不是1:8。
解析:(1)根据e处发生反应的化学方程式判断反应中的氧化剂为KMnO4,还原剂为HCl,其中氧化剂和还原剂的物质的量之比为2:10=1:5,而不是1:8。
(2)b处发生反应为:2KI+Cl2===2KCl+I2,I2遇淀粉显蓝色;d处发生的反应:2FeCl2+C l2===2FeCl3,Fe3+和SCN-反应使溶液变成红色。
l2===2FeCl3,Fe3+和SCN-反应使溶液变成红色。
(3)Cl2与NaOH溶液反应的化学方程式:
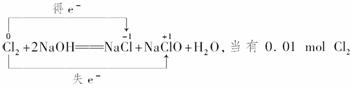
被吸收时,转移0.01 mol电子。
(4)e处实验说明氧化性KMnO4>Cl2;
d处实验说明氧化性Cl2>FeCl3。
因此,三种物质氧化性强弱顺序为:KMnO4>Cl2>FeCl3。
答案:(1)2MnO+16H++10Cl-===2Mn2++5Cl2↑+8H2O 1:5
(2)溶液由无色变为蓝色 溶液由浅黄绿色变为红色
(3)Cl2+2NaOH===NaCl+NaClO+H2O 0.01
(4)能 KMnO4>Cl2>FeCl3
18.(2009·上海单科,24)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为________________________________________________________________________。
(3)根据上述反应可推知________。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3ASO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:
+
解析:此题为氧化还原反应题。
(1)此题考点为氧化还原反应,其特征为化合价升降,本质为电子的转移,要求能从化合价变化角度来判断氧化剂和还原剂。已知KBrO3为得电子物质,故其化合价必是降低,作氧化剂,那么还原剂只能是题目所提供的AsH3,AsH3中As为-3价,反应后变为H3AsO4,故还原剂为AsH3。
(2)此题出题的依据是氧化还原反应中得失电子守恒。0.2
mol KBrO3在反应中得1 mol电子,故每1 mol
KBrO3得5 mol电子,即反应后Br的化合价应降为零价,故另一物质为Br2,同时因为氧化剂、还原剂、 氧化产物、还原产物已知,可直接进行配平。
氧化产物、还原产物已知,可直接进行配平。
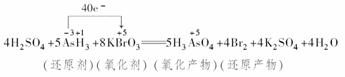
根据化合价升降相等,则应在AsH3前配系数5,在Br2前配系数4,根据原子守恒KBrO3前配8;再根据K原子守恒,K2SO4应在生成物中,系数为4;则H2SO4在反应物中,系数为4;H2O在生成物中,系数为4;配平后用单线桥法标出电子转移方向和数目。
(3)此题的考点为氧化还原反应中的基本规律:氧化剂的氧化性大于氧化产物、还原剂的还原性大于还原产物。故选a、c。
答案:(1)AsH3 (2)Br2 (3)ac (4) 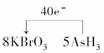
17.(福建福州4月)黄磷(P4)与浓氢氧化钾溶液反应的化学方程式为:P4+3KOH+3H2OPH3↑+3KH2PO2,被氧化的P与被还原的P的质量之比为 ( )
A.1:2 B.2:1
C.3:1 D.1:3
解析:根据反应方程式可以看出,被氧化的P与被还原的P的物质的量之比为3:1,则质量之比也为3:1,C选项正确。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com