
11.(惠州市2009届高三第二次调研考试 )工业上以硫铁矿为原料制硫酸所产生的尾气中含有SO2,为便于监控,实施环境保护,下列适合测定硫酸尾气SO2含量的试剂是
A.品红溶液 B.氨水、酚酞试液 C.碘水、淀粉溶液 D.以上都能
10.(广州市海珠区2009届高三综合测试2)(10分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的部分工艺流程图:
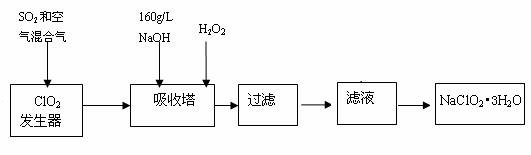
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
②160 g/L NaOH溶液是指160 gNaOH固体溶于水所得溶液的体积为1L。
(1) 吸收塔内的反应的化学方程式为
2NaOH+2ClO2+ H2O2=== 2NaClO2+ 2 + ,
若1 mol ClO2参加反应,则转移电子的物质的量是 mol;
(2)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是 (选填序号),
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是 (填操作名称);
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 ;
 (4)160 g/L NaOH溶液的物质的量浓度为 ,若要计算该溶液的质量分数,
(4)160 g/L NaOH溶液的物质的量浓度为 ,若要计算该溶液的质量分数,
还需要的一个条件是 (用文字说明)。
答案(1) H2O,O2 ;1 (3分)
(2) b、e、d(2分), 重结晶(1分)。
(3)连续测定吸收塔内溶液的pH(1分)
(4)4mol/L(1分,未写单位不给分),该溶液的密度(1分);
9.(广州市海珠区2009届高三综合测试2)(10分)表中所列是周期表ⅥA族(氧族元素)的主要元素,表中内容为该族元素的部分性质。
|
性质\元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃) |
-218.4 |
113 |
|
452 |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径 |
逐渐增大 |
|||
|
单质与H2反应情况 |
点燃易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据表回答下列问题:
(1)硒的熔点范围可能是 ;
(2)碲的化合价可能有 ;
(3)硫、硒,碲的氢化物水溶液的酸性由强至弱顺序是 (填化学式);
(4)氢硒酸有较强的 (填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为 ;
 (5)已知在常温下,生成17g H2S放出56.1KJ的热量,试写出硫化氢分解的热化学方程式:_________________________________;
(5)已知在常温下,生成17g H2S放出56.1KJ的热量,试写出硫化氢分解的热化学方程式:_________________________________;
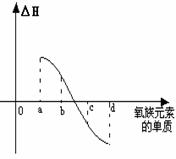 (6)右图所示为氧族元素单质与H2反应过程中的能量
(6)右图所示为氧族元素单质与H2反应过程中的能量
变化示意图,其中a、b、c、d分别表示氧族中某一元素
的单质,△H为相同物质的量的单质与H2反应的反应热。
则:b代表 ,d代表 (均写单质名称)。
答案(1)113 ~ 452℃ (1分)
(2)-2、+4、+6 ( 全对得1分,不全为0分)
(3)H2Te>H2Se>H2S;(1分)
(4)还原性 (1分) 2H2Se + O2 == 2H2O + 2Se (2分)
(5)H2S(g) = H2(g) + S(s);△H = +112.2KJ/mol (2分)
(6)硒 (1分) 氧气 (1分)
8.(广东雷州二中09第三次月考化学试题 )(12分)硫酸铵是一种常用的铵态氮肥。下表是硫酸铵化肥品质的主要指标。
|
指标 项目 |
优等品 |
一等品 |
合格品 |
|
外观 |
白色结晶,无可见机械杂质 |
无可见机械杂质 |
|
|
氮(N)含量 |
≥21.0% |
≥21.0% |
≥20. 5% |
 某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
[观察外观]
该硫酸铵化肥无可见机械杂质。
[实验探究]
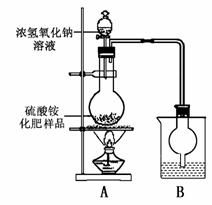
按右图所示装置进行实验。
 (1)烧瓶内发生反应的离子方程式为:
(1)烧瓶内发生反应的离子方程式为:
烧杯中盛放的试剂最好是 (填“浓硫酸”、“稀硫酸”或“水”)
(2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是
[交流讨论]
甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:
乙同学:实验装置中还存在另一个明显缺陷是:
经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验
[探究结论]
称取13.5 g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4 g。则该化肥 (填“是”或“不是”)一等品
答案 (1)NH4+
+ OH-
(1)NH4+
+ OH-  NH3↑+ H2O
(2分);稀硫酸(2分)
NH3↑+ H2O
(2分);稀硫酸(2分)
(2)使硫酸铵充分反应完全转化为NH3 (2分)
[交流讨论] A、B装置间缺一个干燥装置(2分)
缺少赶尽反应装置中残留氨气的装置(2分)
[探究结论]不是 (2分)
7.(2008届汕头市龙湖区第二次高三化学联考).(12分)某混合碱是①Na2CO3和NaHCO3 或② Na2CO3和 NaOH。用“双指示剂法”对样品的组分和总碱量 [n (Na2O) ] 进行测定。实验方案:称取 0.2960g 样品配成 500mL 溶液,取25.00mL置于250mL 锥形瓶中,加适量蒸馏水和几滴酚酞,用0.0100 mol•L-1 的盐酸标准溶液将混合碱滴定成NaHCO3,然后再用溴甲酚绿--二甲基黄为指示剂进行滴定,将NaHCO3完全中和。
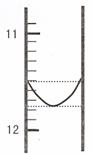 (1)某同学平行滴定了三次,每次滴定从 "0" 点开始读数,其中第 I 次滴定的第一个终点的液面如右图所示,请读出实验数据,填入下列表格中
(1)某同学平行滴定了三次,每次滴定从 "0" 点开始读数,其中第 I 次滴定的第一个终点的液面如右图所示,请读出实验数据,填入下列表格中
|
序号 |
 第一滴定终点的读数(V1/mL) 第一滴定终点的读数(V1/mL) |
第二滴定终点的读数(V2/mL) |
|
I |
? |
26.85 |
|
II |
10.02 |
25.02 |
|
III |
9.98 |
24.98 |
(2)该混合碱样品的组成为 ,理由 。
(3)将混合碱滴定成NaHCO3的过程中,为了结果更加准确,应始终逐滴滴加,这样操作的原因是 。
(4)上述碱样中总碱量[n (Na2O) ]是多少?写出计算过程
。
(5)如果本实验只测定样品的总碱量,实验方案应该怎样设计:
。
答案(1)11.76~11.78均得分 (1分) (2)Na2CO3 和NaHCO3 (2分)因为第一滴定终点所用体积小于第二滴定终点所用体积或V1<(V2-V1)或计算说明 (2分)
(3)以防滴定过快使Na2CO3直接生成H2CO3 (2分)
(4)碱样的总碱量为:
n(Na2O)= [(25.02mL +24.98 mL)/2]×10-3L/ mL×0.0100mol/L×1/2×20=0.0025mol (3分)(第一组数据不可取用,否则不得分;先计算碳酸钠和碳酸氢钠的物质的量,然后计算总碱量,只要计算正确也给分)
(5)直接以溴甲酚绿-二甲基黄或甲基橙为指示剂滴定至终点 (2分)
6.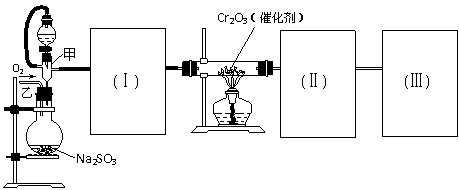 (广东省中山一中09届高三第一次统测 )(12分)用下图装置进行SO2转化为SO3的转化率测定实验:2SO2+O2
(广东省中山一中09届高三第一次统测 )(12分)用下图装置进行SO2转化为SO3的转化率测定实验:2SO2+O2
 2SO3 △H=-196.6kJ/mol
2SO3 △H=-196.6kJ/mol
(1)要顺利进行实验,上图Ⅰ、Ⅱ、Ⅲ处各应连接1个合适的装置,请从下列A~E中选择适宜的装置,将其序号填入空格内。
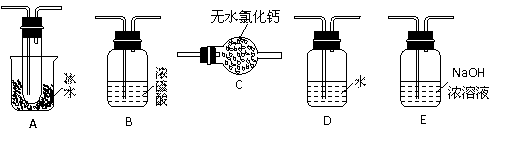
Ⅰ 、Ⅱ 、Ⅲ 。
 (2)实验前,必须进行的操作是(填操作名称,不必写具体过程)
(2)实验前,必须进行的操作是(填操作名称,不必写具体过程)
(3)实验时,浓硫酸能顺利滴入烧瓶中,甲装置所起作用的原理是: 。
(4)从乙处均匀通入O2,为使SO2有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是 。
(5)实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防温度过高,这样做的原因是 若用大火加热有Cr2O3处的反应管时,SO2的转化率会 (填升高、降低或不变)
(6)实验时若用25.2g的Na2SO3,加入的浓硫酸是足量的,反应结束时继续通入O2一段时间,称得Ⅱ处装置的质量增加11.3g,则本实验中SO2的转化率为 。(保留3位有效数字)
答案(1)Ⅰ:B Ⅱ:A Ⅲ:E (各1分,共3分)
(2)检查装置的气密性 (1分)
(3)保持分液漏斗内压强与烧瓶内压强相等 (1分)
(4)先加热催化剂,然后缓慢滴加浓硫酸 (1分)
(5)温度过高不利于SO3的生成,且影响催化剂的活性。 (2分) 降低 (1分)
(6) 70.5% (3分)
5.(广东省中山一中09届高三第一次统测 )强热硫酸亚铁固体可发生如下反应2FeSO4 Fe2O3
+SO2↑+SO3↑若将此反应生成的气体通入BaCl2溶液中,则
A.析出BaSO3沉淀 B.析出BaSO4沉淀
C.逸出SO3气体 D.逸出SO2气体
3.(广东省实验中学2008学年高三第二次阶段测试试卷 )(13分)在化学课上,围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀。然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。请回答:
(1)生成的黑色(单质)物质是 (填化学式)。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是___________ (填化学式),这种黑色物质继续与浓硫酸作用,产生两种气体的化学方程式为____________________
(3)据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有 (填序号)。
A.酸性 B.吸水性 C.脱水性 D.强氧化性
(4)将实验②产生的刺激性气味气体通入品红溶液,可以看到品红溶液____________
说明这种气体具有_____________________性;将②中产生的刺激性气味的气体通入水中可生成一种不稳定、易分解的酸,请写出该反应的化学方程式________________________________
(5)能否用澄清石灰水鉴别这两种气体? (填“能”或“不能”)若不能请填写两种能鉴别的试剂 。
答案(1)C;(2)SO2; C+2H2SO4=加热=CO2+2SO2+2H2O;(3)BCD;(4)褪色,漂白,SO2+H2O=H2SO3;
(5)不能,品红、溴水(其它合理即可)
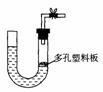 4(广东省中山一中09届高三第一次统测 )下图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是
4(广东省中山一中09届高三第一次统测 )下图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是
A.大理石和稀硫酸制取二氧化碳 B.锌粒和稀硫酸制氢气
C.浓盐酸和二氧化锰制取氯气 D.电石和水制取乙炔
2、(广东漳州市芗城中学高三年10月考)(11分)
某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I-、为鉴别这些离子,分别取少量溶液进行以下实验:
①测得混合液呈碱性;
②加HCl后,生成无色无味气体,该气体能使饱和石灰水溶液变浑浊;
③加CCl4后,滴加少量氯水,振荡后,CCl4后层未变色;
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
⑤加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀。
(1)分析上述5个实验,写出每一步实验鉴定离子的结论与理由。
实验① ;
实验② ;
实验③ ;
实验④ ;
实验⑤ ;
(2)上述5个实验不能确定是否存在的离子是 。
答案(1)①说明可能含有CO32-或者含有SO32- 因为二者水解均显碱性;(结论与理由各1分)
②肯定含有CO32- ,肯定不含SO32-、因SO2有刺激性气味;
③肯定不含有Br-、I-,因两者均能与氯水反应后生成单质溴和单质碘,溴和碘单质溶解于CCl4显色;
④肯定含有SO42-,因BaSO4不溶于盐酸。
⑤肯定含有Cl-,因AgNO3与Cl-反应生成的AgCl不溶于稀HNO3。
(2)NO3-(1分)
1、(广东漳州市芗城中学高三年10月考)(15分)完成下列各题:
(1)试列举出三种不同类别的物质(酸、碱、盐)之间的反应,它们对应的离子方程都可用
“Ba2++SO42-==BaSO4↓”来表示,请写出有关反应的化学方程式(3个)
①________ _;
② _;
③ _ 。
(2)在淀粉KI溶液中加入适量稀硫酸,再滴加少量NaClO溶液,溶液即变蓝色,写出该反应的离子方程式:____________ ____________ ______ ____________。在上述蓝色溶液中滴加足量的Na2SO3溶液,蓝色逐渐消失,写出该反应的离子方程式:
____________ ____________ ______ _____________。
从以上实验可知ClO-,I2,SO32-的氧化性由强到弱的顺序是_________________________。
(3)硫酸铝铵[NH4Al(SO4)2]溶于水能电离出NH4+、Al3+和SO42-。往硫酸铝铵溶液中滴加过量NaOH溶液并加热,写出反应的离子方程式: 。
往硫酸铝铵溶液中滴加过量Ba(OH)2溶液并加热,写出反应的离子方程式:
____________ ____________ ______ _____________。
答案(1)Na2SO4+Ba(OH)2===2NaOH+BaSO4↓(方程式每个2分)
H2SO4+BaCl2===2HCl+BaSO4↓ Na2SO4+BaCl2===2NaCl+BaSO4↓(其他合理答案给分)
(2)2I-+ClO-+2H+===I2+Cl-+H2O SO32-+I2+H2O===2I-+SO42-+2H+
ClO->I2>SO32- (1分)
(3)NH4++Al3++5OH- △ NH3↑+AlO2-+3H2O
NH4++Al3++2SO42-+2Ba2++5OH- △ NH3↑+AlO2-+2BaSO4↓+3H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com