
3.在2L的密闭容器中发生下面反应:A(g)+2B(g)=3C(g),经过3min后A的物质由10mol
变为7mol,则下面表示的反应速率正确的是 ( )
A.vA=1mol·L-1·min-1 B.vB=1mol·L-1·min-1
C.vC=2mol·L-1·min-1 D.vB=2mol·L-1·min-1
2.在可逆反应中,改变下列条件一定能加快反应速率的是 ( )
A.增大反应物的量 B.升高温度
C.增大压强 D.使用催化剂
1. 对于可逆反应2SO2+O2 2SO3(正反应为放热反应),决定反应速率的最主要因素是
( )
对于可逆反应2SO2+O2 2SO3(正反应为放热反应),决定反应速率的最主要因素是
( )
A.温度 B.SO2、O2的性质
C.压强 D.催化剂
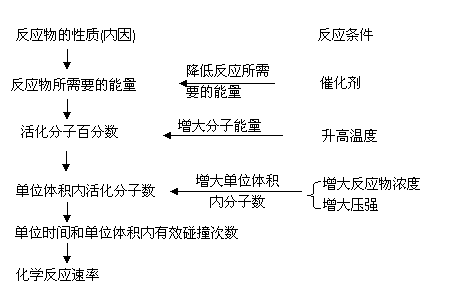
2、外界条件对化学反应速率的影响
⑴浓度:对气体或溶液中发生的化学反应,在其他条件不变时,增大反应物浓度,可以增大反应速率,而与反应物总量无关。
例如:在298K时,反应H2O2+2HI=2H2O+I2的 反应速率v与反应物浓度有以下关系
v=kc(H2O2)×c(HI),其中,比例系数k称为反应速率常数。可见,在k一定的条件下,反应速率随反应物浓度的增大而增大。
有关解释:在其他条件不变时,对某一反应来说,活化分子在反应物中所占的百分数是一定的,因此,单位体积内活化分子的数目与单位体积内反应物分子的总数成正比,也就是和反应物的浓度成正比。当反应物浓度增大时,单位体积内分子数增多,活化分子数也相应增大。譬如,原来每单位体积里有100个反应物分子,其中只有5个活化分子,如果每单位体积内的反应物分子增加到200个,其中必有10个活化分子,那么,单位体积内的有效碰撞次数也相应增多,化学反应速率就增大。因此,增大反应物的浓度可以增大化学反应速率。
 说明:①反应速率常数表示单位浓度下的化学反应速率。通常,反应速率常数越大,反应进行的越快。
说明:①反应速率常数表示单位浓度下的化学反应速率。通常,反应速率常数越大,反应进行的越快。
②反应速率常数与浓度无关,但受温度、催化剂、固体表面性质等因素的影响。
③总反应的化学反应速率与参与反应的物质的浓度的关系式是实验测定的结果,不能随意根据反应的化学方程式直接写出。对于很多反应,这种关系式中浓度的方次与化学方程式中的系数并无确定的关系。
⑵压强:对有气体参加的化学反应,若其他条件不变,增大压强,反应速率加快,减小压强,反应速率减慢。
有关解释:对于气体来说,当温度一定时,一定物质的量的气体的体积与其所受的压强成正比。也就是说,如果气体的压强增大到原来的2倍,气体的体积就缩小到原来的1/2,单位体积内的分子数就增大到原来的2倍,所以增大压强,就是增加单位体积里反应物的物质的量,即增大反应物的浓度,反应速率相应增大;相反,减小压强,气体的体积就扩大,反应物浓度就减小,反应速率也随之减小。
说明: ①若参加反应的物质为固体、液体或溶液,由于压强的变化对它们的浓度几乎无影响,可以认为反应速率不变。
②改变压强的涵义,一般是指:
a.气体物质的量不变,改变容器的容积,比如像SO2(g)+2H2S(g)=3S(s)+2H2O(l),多种反应物都为气体的反应,改变容器的容积后,各种气体的压强、浓度同时并同倍数的变化。
b.气体的容器容积不变,充入气体。比如像 SO2(g)+2H2S(g)=3S(s)+2H2O(l)的反应,气体的容器容积不变,充入SO2气体,p(SO2)、c(S02)都增大;充入O2气体,p(O2)、c(02)都增大;同时充入SO2和O2气体,p(SO2)、p(O2)、与c(S02)、c(02)都增大。
③像化学反应:Zn+H2SO4=ZnSO4+H2↑生成物中有气体,反应物中没有气体,增大压强,速率不增大;减小压强,速率也不减小。
④与化学反应无关的气体对化学反应速率是否有影响,要分情况而定。在一定温度下于密闭容器中进行的化学反应SO2(g)+2H2S(g)=3S(s)+2H2O(l):
a.充入N2并保持容器的容积不变时,虽然容器内气体的总压增大,但由于气体的容积不变,反应物气体的物质的量浓度不变,所以化学反应速率不变。
b.充入N2并保持容器内的总压不变时,必然是容器的容积增大。而气体容积的增大,一定引起反应物浓度的减小,所以化学反应速率减小。
⑤密闭容器的涵义 是指容器全封闭不漏气,容器内外之间没有物质传递。密闭容器不等于容器体积不变。
⑶温度:当其他条件不变时,升高温度可以增大反应速率;降低温度可以减小反应速率。
范托夫经验规律:一般地,温度每升高10℃,反应速率增大2-4倍。
阿伦尼乌斯经验公式: 1889年,阿伦尼乌斯在长期大量实验的基础上,提出了反应速率常数与温度的定量关系:
 k=Ae-Ea/RT
k=Ae-Ea/RT
式中:k为反应速率常数;A为比例系数;e为自然对数的底; R为摩尔气体常量;Ea为活化能,单位为J/mol或KJ/mol。
该经验公式表明:当Ea>0时,升高温度,反应速率常数增大,化学反应速率随之增大。
有关解释:在浓度一定时,升高温度,反应物分子的能量增加,使一部分原来能量较低的分子变成活化分子,从而增加了反应物分子中活化分子的百分数,使有效碰撞次数增多,因而反应速率增大。当然,由于温度升高,会使分子的运动加快,这样单位时间里反应物分子间碰撞次数增加,反应也会相应地加快,但这不是反应速率加快的主要原因,而前者才是反应速率加快的主要原因。
说明:温度对反应速率的影响规律,对吸热反应、放热反应都适用,且不受反应物状态的限制。
⑷催化剂:决定化学反应速率的主要因素是反应活化能的大小。催化剂改变反应速率的原因与浓度、温度对反应速率的影响是不同的。不论浓度还是温度都不能改变反应的活化能,而催化剂则能参与反应,改变反应历程,降低活化能,也就等于提高了活化分子的百分数,从而提高了有效碰撞频率,加快了反应速率。
说明:①催化剂具有选择性 某催化剂对某一反应可能具有很强的催化活性,但对其他反应就不一定具有催化作用。
②催化剂只有在一定温度下才能最大限度地显示其催化作用,不同的催化剂对温度的要求不一定相同。
③催化剂中毒:催化剂的催化活性往往因接触少量杂质而明显下降甚至遭到破坏,这种现象叫做催化剂中毒。工业上为了防止催化剂中毒而把原料进行净化处理以除去使催化剂中毒的物质。
④催化剂不能改变化学平衡常数,不能改变平衡转化率。
知识点3、其他因素对化学反应速率的影响
影响化学反应速率的条件很多,除了浓度、压强、温度、催化剂以外,还有很多行之有效的改变化学反应速率的方法,例如,通过光辐照、放射线辐照、超声波、电弧、强磁场、高速研磨等等,总之,向反应体系输入能量,都有可能改变化学反应速率。
知识点小结

典题解悟
例1、在密闭容器中进行合成氨的反应,开始时的氮气浓度为8mol/L,氢气的浓度为20mol/L,5分钟后氮气的浓度为6mol/L,求v(N2)、v(NH3)、v(H2)。
[解析]在这个反应中,⊿t=5min, ⊿c(N2)=2mol/L,所以v(N2)= ⊿c(N2)/⊿t=2mol/L÷5min=0.4mol/(L•min),再根据γ(N2):γ(H2):γ(NH3)=1:3:2得,⊿c(H2)=6 mol/L ,⊿c(NH3)=4 mol/L,所以 v(NH3)=0.8 mol/(L•min),v(H2)= 1.2mol/(L•min)
答案:在此反应中,N2、H2 、NH3的反应速率分别为0.4mol/(L•min)、1.2mol/(L•min)、0.8 mol/(L•min)。
变形题 对于反应A(g)+3B(g)=2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
A.v(A)=0.01 mol/(L•s) B.v(B)=0.02 mol/(L•s)
C.v(B)=0.60mol/(L•min) D.v(C)=1.0mol/(L•min)
[解析]对于同一反应在不同条件下的反应速率进行比较时,必须选定同一种速率单位和同一种物质,这样比较才有意义。
如选择B物质和单位mol/(L•min),并依据“各物质的速率比等于化学方程式中计量系数比”进行必要的换算。
A中,v(B)=3v(A)=3×60×0.01 mol/(L•s)=1.8mol/(L•min)
B中,v(B)=60×0.02mol/(L•s)=1.2mol/(L•min)
C中,v(B)=3v(C)/2=1.5 mol/(L•min),因此,应选A。
答案:A
例2、在mA+nB=pC的反应中,经过10s的反应后,各物质的浓度变化为:A减少amol/L,B减少0.5amol/L,C增加amol/L,则该反应的化学方程式为______________________。
[解析]根据单位时间内各物质浓度的变化比等于各对应物质的化学计量数之比,即m:n:p=2:1:2。故反应的化学方程式为:2A+B=2C
答案:2A+B=2C
例3、对10ml1mol/L盐酸与一小块大理石的化学反应CaCO3+2HCl=CaCl2+CO2↑+H2O,下列措施能使化学反应速率提高的是( )
A.加入一定量的CaCl2 B.加入1.5mol/L的盐酸5ml
C. 加入0.5 mol/L的盐酸5ml D. 加入5mlH2O
 [解析] CaCl2是反应的生成物,其浓度的最大不能增大反应速率。1.5mol/L的盐酸使1mol/L的盐酸浓度增大,0.5 mol/L的盐酸使1mol/L的盐酸浓度变小。水从一个方面讲它使反应的生成物,其增加不能增大反应速率;从另一方面讲它是反应物HCl的溶剂,其增加使HCl浓度减小。
[解析] CaCl2是反应的生成物,其浓度的最大不能增大反应速率。1.5mol/L的盐酸使1mol/L的盐酸浓度增大,0.5 mol/L的盐酸使1mol/L的盐酸浓度变小。水从一个方面讲它使反应的生成物,其增加不能增大反应速率;从另一方面讲它是反应物HCl的溶剂,其增加使HCl浓度减小。
答案:B
 变形题 在温度不变,恒容容器中进行反应H2 2H, 若反应物浓度从0.1mol/L降到0.06mol/L需20s,那么由降到,所需时间应为( )
变形题 在温度不变,恒容容器中进行反应H2 2H, 若反应物浓度从0.1mol/L降到0.06mol/L需20s,那么由降到,所需时间应为( )
A.等于10s B. 等于12s C. 大于12s D. 小于12s
[解析]若反应以相同的速率进行,所需时间为t=0.024÷0.04×20s=12s,而实际上反应速率随浓度的减小而减小,故浓度由0.06mol/L降到0.036mol/L实际需要的时间大于12s。
答案:C
例4、对于反应N2+O2=2NO,在密闭容器中进行,下列哪些条件能加快该反应的速率( )
A.缩小体积使压强增大 B.体积不变充入氮气使压强增大
C.体积不变充入氦气使压强增大 D.压强不变充入氮气体积增大
[解析]压强对速率的影响,本质是对浓度的影响。A缩小反应体系的体积,总压增大,各物质的浓度均增大,故反应速率加快。B体积不变,充入氮气反应物浓度增大,反应速率加快。C体积不变,充入氦气,总压虽增大,但体系中各物质浓度均没有改变,故反应速率不变。D压强不变,充入氮气,导致体积增大,各物质的浓度除氮气不变外,其余均减小,故反应速率减慢。
答案:AB
 变形题 根据化学反应2SO2+O2
2SO3,取n(SO2)、n(O2)相同,总质量也相同的混合气体(不含SO3)两等份,分别置于密闭容器A、B内,A、B两容器均能使其中的温度保持不变,A还能使其中的压强不变,B能使其容积保持不变。设A、B中的正反应速率分别为a、b,逆反应速率分别为a’、b’。下列关系中正确的是( )
变形题 根据化学反应2SO2+O2
2SO3,取n(SO2)、n(O2)相同,总质量也相同的混合气体(不含SO3)两等份,分别置于密闭容器A、B内,A、B两容器均能使其中的温度保持不变,A还能使其中的压强不变,B能使其容积保持不变。设A、B中的正反应速率分别为a、b,逆反应速率分别为a’、b’。下列关系中正确的是( )
A.a=b B.a>b C.a’>b’ D.a’=b’
[解析]反应从正反应开始,随着反应时间的延长,气体物质的量减小,A中温度不变,压强不变,容积变小了,B中温度不变,容积不变,压强变小了,a>b正确。该可逆反应中的正、逆反应速率都能受压强的影响,a’>b’也正确。
 答案:BC
答案:BC
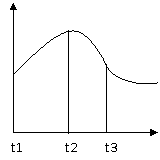
例5把除去氧化膜的镁条放入盛有一定浓度的稀盐酸的试管中,
发现H2的生成速率v随时间t的变化如图所示,
其中t1-t2速率变化的原因是______________________;
t2-t3速率变化的原因是_________________________。
[解析]镁与盐酸溶液的反应是放热反应。该反应中并存两
个影响反应速率的外因,一是反应放出的热使反应体系
 温度升高,化学反应速率加快;二是反应使盐酸的物质
温度升高,化学反应速率加快;二是反应使盐酸的物质
的量浓度降低,化学反应速率减慢。由图像可知,在t1-t2的时间内温度变化是影响化学反应速率的主要外因,在t2-t3的时间内,盐酸浓度的降低是影响化学反应速率的主要外因。
答案:反应是放热反应,温度升高使化学反应速率升高;HCl物质的量浓度变小使化学反应速率降低。
例6、对某一可逆反应来说使用催化剂的作用是( )
A.提高生成物的含量 B.以同样的程度改变v正和v逆
C.增大v正,减小v逆 D.增大v正,v逆不变
夯实基础
1、影响化学反应速率的因素有内因(主要因素)和外因两个方面,内因是指参加反应的物质的性质,外因是指反应进行时所处的外界条件,如温度、浓度、压强和催化剂等。
2、化学反应速率
⑴.基本概念
化学反应速率是用来衡量化学反应进行的快慢的物理量。化学反应速率可以用单位时间内反应物的变化量或生成物的变化量来表示。即:
v=⊿n/⊿t
式中:⊿t表示某段时间间隔;⊿n表示该时间间隔内反应物或生成物的物质的量的变化。
对于体积不变的化学反应体系,通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示化学反应速率。即
v=⊿c/⊿t
⑵.表示方法
对任意一个化学反应:mA+nB=pY+qZ,反应体系中各物质的浓度分别表示为c(A)、c(B)、c(Y)、和c(Z),则反应速率分别表示为:
v(A)=⊿c(A)/⊿t,v(B)=⊿c(B)/⊿t, v(Y)=⊿c(Y)/⊿t, v(Z)=⊿c(Z)/⊿t。
关于反应速率的几点说明:
 ① 一个确定的化学反应涉及反应物和生成物多种物质,在中学化学里,通常笼统地说化学反应速率快慢时,往往是对整体化学反应而言,如HCl+NaOH=NaCl+H20反应很快,而 CH3COOH+CH3CH2OH=CH3COOC2H5+H20反应很缓慢。定量表示化学反应速率时,是对某种具体物质而言,如在N2+3H2=2NH3中,v(N2)=0.5mol/(L•min)等。
① 一个确定的化学反应涉及反应物和生成物多种物质,在中学化学里,通常笼统地说化学反应速率快慢时,往往是对整体化学反应而言,如HCl+NaOH=NaCl+H20反应很快,而 CH3COOH+CH3CH2OH=CH3COOC2H5+H20反应很缓慢。定量表示化学反应速率时,是对某种具体物质而言,如在N2+3H2=2NH3中,v(N2)=0.5mol/(L•min)等。
② 某一段时间内的化学反应速率,实际上是指这一段时间内反应的平均反应速率,而不是指某一时刻的瞬时速率。
③ 化学反应速率是标量,无论是反应物还是生成物,其化学反应速率值都取正值,不取负值。
④ 在一定温度下,固体或纯净液体物质,单位体积内的物质的量保持不变,即物质的量浓度为常数,因此,它们的化学反应速率不适合用单位时间内物质的量浓度变化来表示,但可以用单位时间内的物质的量的变化来表示.
 ⑤ 由于一个化学反应里各物质之间化学计量数不一定相同,所以在同一个化学反应里,用不同物质来表示的化学反应速率不一定相同.例如,2SO2+O2 2SO3,在1min内的时间里,当SO2的浓度减少0.5mol/L时,O2浓度减少0.25 mol/L,SO3浓度增加0.5mol/L,v(SO2)=v(SO3)=0.5mol/L,V(O2)=0.25mol/L。因此,在同一个化学反应里,虽然用不同的物质表示的化学反应速率值不一定相同,但它们的实际意义却是完全相同的,即一种物质的化学反应速率也就代表整个化学反应的速率,而且,用不同物质表示的化学反应速率之比等于化学方程式中的各物质的化学计量系数比。
⑤ 由于一个化学反应里各物质之间化学计量数不一定相同,所以在同一个化学反应里,用不同物质来表示的化学反应速率不一定相同.例如,2SO2+O2 2SO3,在1min内的时间里,当SO2的浓度减少0.5mol/L时,O2浓度减少0.25 mol/L,SO3浓度增加0.5mol/L,v(SO2)=v(SO3)=0.5mol/L,V(O2)=0.25mol/L。因此,在同一个化学反应里,虽然用不同的物质表示的化学反应速率值不一定相同,但它们的实际意义却是完全相同的,即一种物质的化学反应速率也就代表整个化学反应的速率,而且,用不同物质表示的化学反应速率之比等于化学方程式中的各物质的化学计量系数比。
知识点2、影响化学反应速率的因素
1、化学反应有快慢之别
⑴ 对于不同的化学反应,进行的快慢有很大的差别,有些反应进行的很快,甚至可在瞬间完成,如离子反应,爆炸反应等;有些反应则进行的很慢,基本上看不出变化,如金属的腐蚀、橡胶的老化等;还有些反应开始时很慢,但反应进行一段时间后,不断加快,如自催化反应等。
⑵从化学反应实质看化学反应速率 化学反应的实质就是反应物分子中的原子重新组合成生成物分子的过程,也就是反应物分子中化学键的断裂,生成物分子中化学键的生成过程。如果反应物分子的结构稳定,即反应物的化学键键能较大,则反应物就较难发生化学反应,相对来说反应速率就慢些。
⑶从化学反应的过程看化学反应速率 大多数化学反应都是分若干步完成,即在一定条件下,某反应物间的化学反应,都有自己特殊的反应历程。反应物的结构和性质以及反应条件共同决定着一个化学反应的历程,而反应历程的差别又造成了化学反应速率的不同。即不同的反应物,有不同的反应历程;相同的反应物,在不同的条件下,也会有不同的反应历程,因而其化学反应速率也不一样。
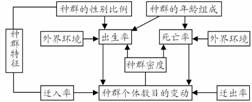
(六)种群特征之间的关系(如右图)
[思考感悟]某种群中具有生殖能力的雌性个体多于雄性个体,则该种群数量的变化趋势如何?
雌性比例大,导致出生率较高,因而该种群数量会越来越大。
[基础训练]1、预测一个国家或地区人口数量未来的动态信息主要来自( A )
A、现有居住人口不同年龄组成的比例 B、现有人口数量和密度
C、现有出生率、死亡率和迁移率 D、现有人口男女性别比例
2、用“样方法”调查蒲公英种群密度的过程是( B )
①选取一个该种群分布比较均匀的长方形地块,将该地按长度划成10等份,在每份的中央画一个大小为1m2的样方;②选取一个该种群分布比较集中的长方形地块,将该地按照长度划成10等份,在每份的中央画一个大小不同的样方;③计数每个样方内该种群数量,取其最大值作为种群密度的估计值;④计数每个样方内该种群数量,取其平均值作为该种群密度的估计值。
A、①③ B、①④ C、②③ D、②④
3、如下甲图为种群的三种典型的年龄组成类型,乙图为种群的三个典型存活类型。
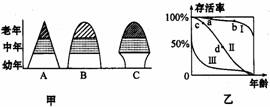 (1)在渔业生产中,必须严格控制鱼网孔眼大小,保证水域中该鱼种群年龄组成出现甲图中的A类型,才能保证鱼产量的稳定。
(1)在渔业生产中,必须严格控制鱼网孔眼大小,保证水域中该鱼种群年龄组成出现甲图中的A类型,才能保证鱼产量的稳定。
(2)若乙图表示对三个经营多年的养猪场的调查结果,则经营最好的为Ⅱ猪场,而另外两个经营不好的原因是:Ⅲ猪场因饲养等技术问题造成幼猪大量死亡;Ⅰ猪场因市场营销问题造成老年猪积压。
(3)根据生活常识,判断下列生物分别属于乙图中哪种类型生物:人Ⅰ,鸟Ⅱ,蛙Ⅲ。
(4)某害虫种群年龄组成虽为A增长型,但有关专家却推断它不会泛滥成灾,因为这种害虫的年龄存活曲线如乙图中Ⅲ曲线。
[高考模拟]4、(2007江苏生物41)“标志(记)重捕法”是动物种群密度调查中的一种常用取样调查法:在被调查种群的生存环境中,捕获一部分个体(M)全部进行标记后释放,经过一段时间后进行重捕,根据重捕中标记个体数(m)占总捕获数(n)的比例,估计该种群的数量(N)。某研究机构对我国北方草原一种主要害鼠--布氏田鼠进行了调查。调查样方总面积为2hm2。(1hm2=10000m2),随机布设100个鼠笼,放置l夜后,统计所捕获的鼠数量、性别等,进行标记后放归;3日后进行重捕与调查。所得到的调查数据如下表。
|
|
捕获数/只 |
标记数/只 |
雌性个体数 |
雄性个体数 |
|
初捕 |
32 |
32 |
14 |
18 |
|
重捕 |
36 |
4 |
18 |
18 |
(1)假定重捕取样中标记比例与样方总数中标记比例相等,写出样方中种群总数(N)的计算公式N=Mn/m。
(2)该草地布氏田鼠的平均种群密度为144只/hm2。事实上田鼠在被捕捉过一次后更难捕捉,上述计算所得的平均种群密度与实际种群密度相比可能会偏高。
(3)综合两次捕获情况,该田鼠种群的性别比例(♀/♂)为8/9(或32/36)。
(4)在上述调查的同时,还对样方中布氏田鼠的洞口数进行了调查(假设样方中只有这一种鼠),平均每100m2有3.6个洞口,洞口数与田鼠数的比例关系为2.5︰1。
5、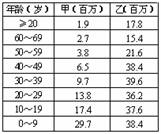 (2007北京理综4)根据下表中甲、乙两个国家各年龄段的人口数量统计数据,判断下列叙述正确的是 ( B )
(2007北京理综4)根据下表中甲、乙两个国家各年龄段的人口数量统计数据,判断下列叙述正确的是 ( B )
A、甲属于人口稳定型国家,乙属于人口衰退型国家
B、甲属于人口增长型国家,乙属于人口稳定型国家
C、甲属于人口增长型国家,乙属于人口衰退型国家
D、乙属于人口衰退型国家,乙属于人口稳定型国家
(四)年龄组成
1、概念:一个种群中各年龄期的个体数目的比例。
2、类型
(1)增长型:种群中年幼个体很多,年老个体很少,种群正处于增长期,种群密度会增大。
(2)稳定型:各年龄期的个体数目比例适中,种群正处于稳定时期。
(3)衰退型:年幼个体较少,而年老个体较多,种群正处于衰退时期,种群密度会减少。
3、研究意义:对于预测种群密度未来变化趋势具有重要意义。
 (五)性别比例
(五)性别比例
种群中雌雄个体数目的比例。
(三)迁入率和迁出率
1、概念:单位时间内迁入或迁出的个体,占该种群个体总数的比率。
2、研究意义:影响种群大小和种群密度变化的重要因素。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com