
8.(08山东实验中学第三次模拟)下列反应的离子方程式正确的是( D )
A.少量二氧化硫气体通入到漂白粉溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
B.碳酸钠的水解:CO32-+2H2O--H2CO3+2OH-
C.少量的钠投入足量的水中:Na+2H2O=Na+2OH-+H2↑
D.向硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7:
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
7.(08山东实验中学第三次模拟)下列离子组能够在溶液中共存,加入NaOH溶液有沉淀生成,加入稀盐酸有气体放出的是( D )
A.Na+、Fe2+、Cl-、SO42- B.Ba2+、K+、CO32-、Cl-
C.Al3+、Ca2+、Cl-、NO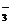 D.Na+、Ba2+、NO
D.Na+、Ba2+、NO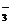 、HCO
、HCO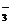
6.(08潍坊高三质检)某溶液含有①NO3- ②HCO3- ③SO32- ④CO32- ⑤SO42-等五种阴离子。向其中加入少量的Na2O2固体后,溶液中的离子浓度基本保持不变的是(忽略溶液体积的变化)
( )A.① B.①②④ C.①③⑤ D.①③④⑤
5.(08潍坊高三质检)下列反应的离子方程式书写正确的是 ( )
A.用氨水吸收少量SO2气体:2NH3·H2O+SO2=2NH4++SO32-+H2O
|
C.NH4HCO3溶液与过量的NaOH溶液共热:NH4++OH-
NH3↑+H2O
D.C12通入水中:C12+H2O=2H++C1-+C1O-
4.(08潍坊高三质检)下列离子在酸性溶液中能大量共存的是 ( )
A.Na+、K+、C1O-、I- B.C1-、NO3-、Fe2+、Na+
C.K+、Ba2+、OH-、SO42- D.Fe3+、NH4+、Br-、NO3-
3.(08枣庄三诊)下列有关化学用语的叙述正确的是 ( )
 A.硫酸铝水解的化学方程式是:Al2(SO4)3+3H2O 2Al(OH)3+3H2SO4
A.硫酸铝水解的化学方程式是:Al2(SO4)3+3H2O 2Al(OH)3+3H2SO4
B.铜跟浓硝酸反应的离子方程式是:
Cu+4HNO3(浓)=Cu2++2NO3-+2NO2↑+2H2O
C.钢铁发生吸氧腐蚀时,负极发生的电极的反应为:2H2O+O2+4e-→4OH-
D.氢氧化亚铁在空气中久置变成红褐色的化学方程式为:
4Fe(OH)2+O2+2H2O 4Fe(OH)3
2.(08淄博第一次调研)向存的大量Na+、C1-的溶液中通入足量的NH3后,该溶液中还可能大量存在的离子组是
( )
A.K+、Br-、CO32- B.A13+、H+、MnO4-
C.NH4+、Fe3+、SO42- D.Ag+、Ca2+、NO3-
1.(08淄博第一次调研)下列反应的离子方程式书写不正确的是 ( )
A.浓烧碱溶液中加入铝片:2A1+2OH-+H2O=[A1(OH)4]-+H2↑
|
B.以石墨作为电极电解氯化钠溶液:2C1-+2H2O 2OH-+H2↑+C12↑
C.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+ 2Fe3++2H2O
D.氢氧化钠溶液中通入过量CO2气体:CO2+2OH- CO32-+H2O
2.有离子参加或生成的反应叫做离子反应,电解质在水溶液中的反应属于离子反应,离子反应可用离子方程式表示。离子方程式是用实际参加反应的离子的符号表示离子反应的式子。它表示同一类型的所有的离子反应。如Ca2++CO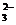
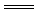 CaCO3↓表示可溶性钙盐和可溶性碳酸盐在溶液中进行的反应。书写离子方程式可按以下步骤:
CaCO3↓表示可溶性钙盐和可溶性碳酸盐在溶液中进行的反应。书写离子方程式可按以下步骤:
①写:写出化学方程式,并配平;
②拆:将可溶性强电解质写成离子形式,难溶、难电离的物质、氧化物和气体写成化学式;
③删:删去两边没反应的离子;
④查:检查是否符合质量守恒、电荷守恒、反应事实等。
如何判断一个离子方程式的正误呢?一个正确书写的离子方程式,应当是:
①必须符合客观事实。如离子方程式Cu+2H+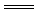 Cu2++H2↑很显然是错误的。
Cu2++H2↑很显然是错误的。
②必须符合拆写原则。如将石灰石加入稀盐酸中的离子方程式写成CO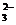 +2H+
+2H+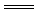 H2O+CO2↑就是错的。错在将难溶于水的CaCO3写成了CO
H2O+CO2↑就是错的。错在将难溶于水的CaCO3写成了CO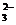 ,正确离子方程式应当是CaCO3+2H+
,正确离子方程式应当是CaCO3+2H+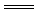 Ca2++H2O+CO2↑。
Ca2++H2O+CO2↑。
③必须遵守质量守恒定律。有人将Na2CO3与稀硫酸反应的离子方程式写成了CO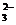 +H2O+CO2↑,因为方程式两边氢原子的个数不相等,所以是错误的,正确的应当是CO
+H2O+CO2↑,因为方程式两边氢原子的个数不相等,所以是错误的,正确的应当是CO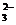 +2H+
+2H+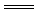 H2O+CO2↑
H2O+CO2↑
④必须遵守电荷平衡原理。如:铝与稀硫酸反应:A1+2H+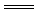 Al3++H2↑(错误),正确的是:2A1+6H+
Al3++H2↑(错误),正确的是:2A1+6H+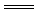 2Al3++3H2↑
2Al3++3H2↑
⑤必须符合阴、阳离子的个数配比。如:氢氧化钡和硫酸溶液反应:
错误:Ba2++OH-+H++SO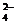
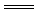 BaSO4↓+H2O,不符合离子的个数配比,一个Ba2+结合的OH-有2个,两个H+对应一个SO
BaSO4↓+H2O,不符合离子的个数配比,一个Ba2+结合的OH-有2个,两个H+对应一个SO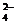 。 正确:Ba2++2OH-+2H++SO
。 正确:Ba2++2OH-+2H++SO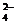
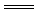 BaSO4↓+2H2O
BaSO4↓+2H2O
新课标高一化学练习附加系列2:
20(7分).取一定量的Na2CO3和Na2SO4混合物溶液与过量盐酸反应,生成2.016 L CO2(STP),然后加入足量的Ba(OH)2溶液,得到沉淀的质量为2.33 g。试计算混合物中Na2CO3和Na2SO4的物质的量分别为多少。
知识盘点
1.在水溶液中或熔融状态下能够导电的化合物称为电解质,若是在以上两种情况下都不导电的化合物则称为非电解质。酸、碱、盐在水溶液中能够导电,是因为它们在溶液中发生了电离,产生了能够自由移动的离子。因此,电离是电解质溶液导电的前提。但能导电的物质不一定是电解质,如石墨、铜等;电解质本身不一定能导电,如食盐晶体。
酸、碱、盐等电解质在水溶液中的电离过程可用电离方程式表示,如:H2SO4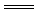 2H++SO
2H++SO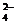 ,Ba(OH)2
,Ba(OH)2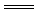 Ba2++2OH-,KNO3
Ba2++2OH-,KNO3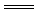 K++NO
K++NO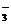 等。电解质溶液的导电能力取决于在相同条件下单位体积内自由移动的离子的数目及其所带电荷的多少。在电解质溶液中,阳离子所带正电荷总数与阴离子所带负电荷的总数是相等的,故溶液显电中性,称电荷守恒。因为电解质溶于水后电离出离子,所以电解质在溶液中的反应必然有离子参加。
等。电解质溶液的导电能力取决于在相同条件下单位体积内自由移动的离子的数目及其所带电荷的多少。在电解质溶液中,阳离子所带正电荷总数与阴离子所带负电荷的总数是相等的,故溶液显电中性,称电荷守恒。因为电解质溶于水后电离出离子,所以电解质在溶液中的反应必然有离子参加。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com