
15.(1)NaOH应放在干燥的烧杯中称量
(2)用过的游码未拨回原处
(3)托盘天平只能称出0.1-0.2g,称不出1.00g
(4)烧杯和玻璃棒未洗涤,洗涤液亦应转入容量瓶
(5)溶解NaOH应冷却后再转移至容量瓶中
(6)容量瓶中的溶液未摇匀
(7)配好的溶液应及时转移到有胶塞的试剂瓶内
14.D 解析:本题全面考查本章的几个重要概念。不仅要理解每个概念的含意,更要弄清各个概念的来龙去脉及应用前提。A考查的是气体摩尔体积,其适用范围是气体,而不是任何物质;B考查的是物质的量浓度与溶液中粒子个数的关系。因盐酸是一元强酸,硫酸是二元强酸,故物质的量浓度相等的盐酸和硫酸中,H+的物质的量浓度后者应是前者的两倍;C考查的是物质的量与所含粒子(包括分子和原子)、物质的量与物质,的质量之间的关系。D考查的是对气体摩尔体积的概念的理解。6LO2可能是在非标准状况下,在这条件下气体摩尔体积可能为24L·mol-1,则该状况下的6LO2的物质的量为0.25mol,质量为32g·mol-1×0.25mol=8g。
0.1L)也不等于22.5L而必须已知溶液的密度才能求出溶液的体积。本题中溶剂的质量等于1g·mL-1×100mL=100g,溶质的质量等于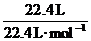 ×36.5g·mol-1=36.5g,故可求出溶液中溶质的质量分数。
×36.5g·mol-1=36.5g,故可求出溶液中溶质的质量分数。
A项因溶液的体积不等于0.1L,而推知物质的量浓度不等于10mol·L-1。C项不难求出溶质质量为36.5g,溶剂质量为100g,故可求出溶质质量分数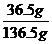 ×100%=26.7%。D项溶液的体积不等于溶剂和溶质的体积之和,故所得溶液的体积不等于22.5L。所以本题答案为B。
×100%=26.7%。D项溶液的体积不等于溶剂和溶质的体积之和,故所得溶液的体积不等于22.5L。所以本题答案为B。
13.B 解析:本题主要考查学生对物质的量浓度的概念的理解并巩固溶液中溶质质量分数的概念及相关计算。溶液的物质的量浓度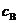 等于溶质的物质的量除以溶液的体积,而不是除以溶剂的体积。向100mL水中溶解了22.4L气体后,溶液体积会发生一些变化,不再是原来的100mL。
等于溶质的物质的量除以溶液的体积,而不是除以溶剂的体积。向100mL水中溶解了22.4L气体后,溶液体积会发生一些变化,不再是原来的100mL。
12.B 解析:A、C、D都将造成溶质的物质的量偏小,故所配溶液的浓度偏低。只有B会造成溶液体积偏小,故浓度偏高。
11.A 解析:这是一道考查物质的量概念的选择题,正确的解题思路是从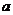 g气体中含有的分子数为
g气体中含有的分子数为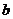 入手,用
入手,用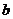 除以阿伏加德罗常数
除以阿伏加德罗常数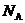 求出
求出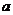 g气体的物质的量,再乘以气体摩尔体积,求出
g气体的物质的量,再乘以气体摩尔体积,求出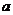 g气体在标准状况下占有的体积
g气体在标准状况下占有的体积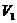 ,即
,即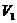 =
=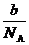 ×22.4L,然后,列比例式求出
×22.4L,然后,列比例式求出 g该气体在标准状况下占有的体积
g该气体在标准状况下占有的体积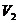 ,即
,即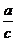 =
=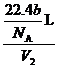 ,
,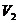 =
=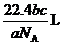 。
。
10.D 解析:要求溶液的物质的量浓度,需知溶质的物质的量和溶液的体积。溶液的体积不等于HCl(g)的体积,也不等于HCl(g)和H2O的体积之和,而要根据溶液的密度求得:
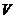 (HCl(aq))=
(HCl(aq))=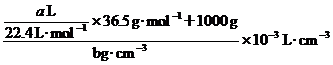
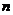 (HCl)=
(HCl)=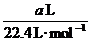
 (HCl)=
(HCl)=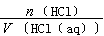 =
=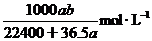
9.AD 解析:首先要理解题意,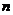 molN2和mol14CO是物质的量相等的两种气体,根据阿伏加德罗定律,可以判断A正确。
molN2和mol14CO是物质的量相等的两种气体,根据阿伏加德罗定律,可以判断A正确。
N2和14CO的摩尔质量不相等(N2∶28g·mol-1,而14CO:30g·mol-1),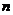 molN2和nmol14CO的质量不相等,同温同压下,它们体积相等,所以它们的密度一定不相等,在标准状况下,也属于同温(0℃)、同压(1.01×105Pa),所以它们只是体积相等,而质量不等,两种气体的物质的量相等,它们的分子数一定相等。
molN2和nmol14CO的质量不相等,同温同压下,它们体积相等,所以它们的密度一定不相等,在标准状况下,也属于同温(0℃)、同压(1.01×105Pa),所以它们只是体积相等,而质量不等,两种气体的物质的量相等,它们的分子数一定相等。
8.AD 解析:同温同压下,气体密度比等于相对分子质量之比: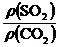 =
=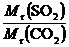 =
=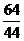 =
=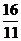 ,同温同压下,等质量的气体体积比等于相对分子质量的反比,即
,同温同压下,等质量的气体体积比等于相对分子质量的反比,即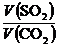 =
=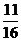 。
。
7.A 解析:依题意,原NaOH溶液的浓度是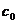 =
=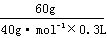 =5mol·L-1。
=5mol·L-1。
设原溶液与水混合时体积不变,则以体积比1∶4稀释即成试题所要求的溶液。因此,选项A是本题答案。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com