
6.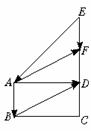 已知向量a=(x+3,x2-3x-4)与
已知向量a=(x+3,x2-3x-4)与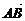 相等,其中A(1,2),B(3,2),求实数x的值.
相等,其中A(1,2),B(3,2),求实数x的值.
5.已知α、β是实数,a,b是不共线的向量,若(2α+β-4)a+(α-3β)b=0,则α=_________,β=_________.
4.D、E、F分别是△ABC边AB、BC、CA上的中点(如图),则等式
(1)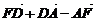 =0;
=0;
(2)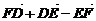 =0;
=0;
(3)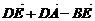 =0;
=0;
(4)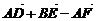 =0;
=0;
其中正确的是_________.
3.下面给出四个命题:
(1)对于实数m和向量a、b恒有:
m(a-b)=ma-mb;
(2)对于实数m,n和向量a,恒有:
(m-n)a=ma-na;
(3)若ma=mb(m∈R),则a=b;
(4)若ma=na(m,n∈R,a≠0),则m=n.
其中正确命题的个数是
A.1 B.2 C.3 D.4
2.已知△ABC中,AB=AC,DE是两腰上的中位线,则下列结论正确的是
A.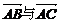 共线 B.
共线 B.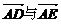 相等
相等
C.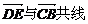 D.
D.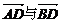 相等
相等
1.下列各量中是向量的是
①质量;②密度;③距离;④位移;⑤浮力;⑥电流强度;⑦风速;⑧功;⑨温度.
A.③④⑤ B.③⑤⑥ C.④⑤⑦ D.⑦⑧⑨
17.(桐乡高级中学高三化学10月考试卷) 已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:
 请回答以下问题:
请回答以下问题:
电解时,粗铜应与电源的 极相连。阴极上的电极反应式为 。
电解过程中,硫酸铜的浓度会 (选填:变大、不变、变小)。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
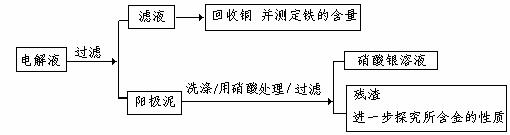
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式: 。
 残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
|
序号 |
反应 |
平衡常数 |
|
1 |
Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O |
<< 1 |
|
2 |
Au3+ +
4Cl- = AuCl4- |
>>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因: 。
(2)滤液含量的测定:
以下是该小组探究滤液的一个实验流程:
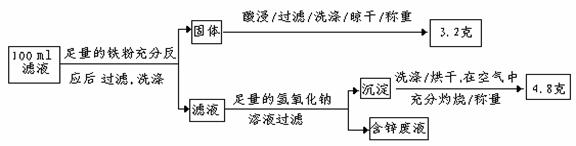
则100mL滤液中Cu2+ 的浓度为 mol·L-1 ,Fe2+的浓度为 mol·L-1
答案
步骤一:正 ;Cu2++2e = Cu ;变小
步骤二:(1)3Ag + 4H+ + 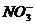 = 3Ag+
+ NO↑+ 2H2O ;浓盐酸含有大量氯离子,Au3+ 离子与氯离子形成稳定的AuCl4-离子,使反应2平衡向右移动,则金溶于王水中
= 3Ag+
+ NO↑+ 2H2O ;浓盐酸含有大量氯离子,Au3+ 离子与氯离子形成稳定的AuCl4-离子,使反应2平衡向右移动,则金溶于王水中

(2)0.5 ;0.1


16.(自贡市高2009级高三理科综合能力测试“一模”)
如下图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题。
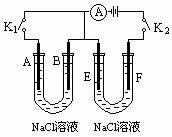 (1)打开K2,闭合K1。
(1)打开K2,闭合K1。
 B为 极,A的电极反应为
,最终可观察到的现象是 ,涉及的化学反应方程式有:
B为 极,A的电极反应为
,最终可观察到的现象是 ,涉及的化学反应方程式有:
;
。
(2)打开K1,闭合K2。
E为___________极,F极的电极反应为________ __________,检验F极产生气体的方法是___________ ____________________。
(3)若往U型管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是______________________________,原因是________________________ ____________ ______ 。
答案
(1)负 O2 + 2H2O +
4e- = 4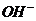 溶液中有红褐色沉淀生成
溶液中有红褐色沉淀生成
2Fe+ O2 +2H2O =2Fe(OH)2 ; 4Fe(OH)2 + O2 +2H2O= 4Fe(OH)3
(2)阴 2Cl- - 2e- = Cl2↑
用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,证明是氯气
(3)AE
因为 A极产生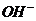 ;E极中H+反应了,促进了水的电离,E极附近溶液中有OH-剩余,所余OH-遇酚酞变红
;E极中H+反应了,促进了水的电离,E极附近溶液中有OH-剩余,所余OH-遇酚酞变红
15.
 有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂溶解在亚硫酰氯(SOCl2)中形成,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,已知亚硫酰氯和AlCl3·6H2O混合共热蒸干,可制得无水AlCl3,则下列叙述正确的是 ( )
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂溶解在亚硫酰氯(SOCl2)中形成,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,已知亚硫酰氯和AlCl3·6H2O混合共热蒸干,可制得无水AlCl3,则下列叙述正确的是 ( )
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的负极,石墨作电池的正极
C.电池工作过程中,SOCl2 被还原为Li2SO3
D.电池工作过程中,负极消耗锂与正极区析出的S的质量之比为7:8
答案:BD
14.下列各种方法中:①金属表面涂抹油漆,②改变金属的内部结构,③保持金属表面清洁干燥,④在金属表面进行电镀,⑤使金属表面形成致密的氧化物薄膜。能对金属起到防止或减缓腐蚀作用的措施是 ( )
A.①②③④ B.①③④⑤
C.①②④⑤ D.全部
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com