
1.C 2.A 3.A 4.C 5.B 6.C 7.AD
讲析:3.铜未被腐蚀,被保护起来。4.不同种金属(包括一些非金属)在熔化状态下形成的熔合物或冷却后的固体,它们的熔点要接近,最高者且与其他相差较大的是W. 5.由Mg生成MgO,质量增加的倍数小于1,则另一金属变为氧化物后质量增加的倍数应大于1。6.(b-a)g即为SO42-离子的质量,n(H2) =n(H2SO4) =n(SO42-)=(b-a)g/96,则m(H2)= (b-a) /48 g。7.溶液中含溶质H2SO4的物质的量为:0.1 L×4mol·L-1=0.4mol。当硫酸溶液浓度降低一半时即消耗了0.2mol H2SO4,放出0.2molH2,得到0.4mol电子,而失去0.4mol电子的金属的质量应小于5g,从而可以推出失去1 mol电子的金属的质量应小于5/0.4=12.5(s)。四种金属失去1 mol电子时相应的质量分别为:
Al:27 g/3=9 g Zn:65 g/2=32.5 s
Fe:56/2=28g Mg:24g/2=12g
5.(1)负极4Au+8CN-4e- =4[Au(CN)2]-
正极O2+2H2O+4e-=4 OH-
(2)Zn+2[Au(CN)2]- =[Zn(CN)4]2- +2Au
讲析:这道题目看起来比较生疏,但认真审清题意,不难发现,用氰化钠溶液,通入空气溶解金的原理,与钢铁的电化腐蚀原理完全相似。写出锌和Na[Au(CN)2]发生置换反应的离子方程式,主要是根据题目给出的信息得出Na[Au(CN)2]是强电解质。
检测提高
4.(1)①CuSO4+Fe=Cu+FeSO4
②Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O
或 Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O
③CH2(OH)(CHOH)4CHO+2Cu(OH)2
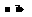 CH2(OH)(CHOH)4COOH+Cu2O↓+2H2O
CH2(OH)(CHOH)4COOH+Cu2O↓+2H2O
(2)铜的化学性质比较稳定,不易被腐蚀,铜的熔点比较低,容易冶炼铸造成型。
1.AB 2.A 3.D
讲析:2.题干告知,硬铝是“古铜色”,则肯定含有红色物质,由样品分析实验所表现的现象,遍观各备选项,呈红色的只有金属铜,因而选A。3.依据金属性强的金属可以从盐溶液中置换出金属性弱的金属这一事实,可知选项A中的金属强弱顺序为:B,C,A。而判断金属性强弱的根本依据是失电子能力的大小,与失电子数目的多少无关,如钠原子只失一个电子,而铝可失三个,而钠的金属性强于铝,故B错。一般情况下,非变价金属元素的阳离子氧化性越强,其金属性越弱,但对变价金属,这一规律例外,如:Fe3+的氧化性强于Cu2+,但金属性Cu弱于Fe,故C错。答案:D
9.(1)①旧金属的收集;②与其他废物的分离;③回收和提炼金属的费用;④金属本身的价值;⑤人们的环境意识薄弱。
(2)①金属本身的价值;②金属的活动性。
 (3)①Al2O3+2NaOH=2NaAlO2+H2O
(3)①Al2O3+2NaOH=2NaAlO2+H2O
②NaAlO2+CO2+2H2O= A1(OH)3↓+NaHCO3
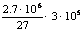 ③2A1(OH)3 Al2O3+
3H2O
③2A1(OH)3 Al2O3+
3H2O
(4)W=QU=6× =1.8×1011J=1.8×108kJ
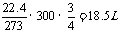 (5)每产生1molAl,则产生0.75molO2,换算为非标况下有:V(O2)=
(5)每产生1molAl,则产生0.75molO2,换算为非标况下有:V(O2)=
第33课时 (B卷)
纠错训练
8.A:K;B:Cu;C:Ag;D:Zn;E:Fe;F:Pt;G:Sn
1.D 2.B 3.B 4.C 5.D 6.B 7.A
讲析:2. A不正确,对于变价金属离子较低价态(如Fe2+)的既有氧比性又有还原性。少数金属在常温下为非晶体,如Hg。 3.只要了解Ca是人体骨骼的组成元素,而Fe是人体血红蛋白的组成元素之一。不要将二者混淆。 4.根据金属活泼性强弱的判断规律:①能在水溶液中发生置换反应。一定X>Y,且均不是A1以前的金属;②与冷水反应放出H2,为活泼金属;③原电池中负极活泼,M>N;④Y可与稀H2SO4反应,M不能,则:Y>M。故答案为C。 5.首先明确要比较的三种物质的晶体类型,铝、铝硅合金为金属晶体,而硅是原子晶体,熔点最高,又因合金的熔点比各成分熔点都低,从而选出答案 D。 6.0.02mol甲放入1L0.01mol/L的盐酸中,盐酸不足,放出H2取决于酸的量,但过量的Na、K能与水反应放出H2。放出H2量:A=B=D>C。再加入0.01mol乙,Mg与碱不反应,0.01molAl与碱(NaOH过量)反应产生0.15molH2,0.01molNa、0.01molK与水反应只产生0.005molH2。故B选项产生H2最多。(注意Al与NaOH溶液反应要放出H2。)
4.(1)①;③;③;④
 Cu2(OH)2CO3 2CuO+H2O+CO2↑
Cu2(OH)2CO3 2CuO+H2O+CO2↑
 C+2CuO 2Cu+CO2↑
C+2CuO 2Cu+CO2↑
 (2)②Fe2O3+3CO 2Fe+3CO2↑,
(2)②Fe2O3+3CO 2Fe+3CO2↑,
 WO3+3H2
W+3H2O;
WO3+3H2
W+3H2O;
 ③3MnO2+4Al 3Mn+2 Al2O3
③3MnO2+4Al 3Mn+2 Al2O3
④2NaCl 2Na + C12↑
讲析: 4种方法有一个共同点,都是从金属化合物
 里把金属还原出来。焦炭、氢气、一氧化碳是常使用的还原剂,方法①、②一般冶炼不活泼或较活泼的金属,如铜、铁等。活泼金属置换法,一般在水溶液中进行,也可以是粉末状。在工业上利用铝热反应,用铝作还原剂冶炼难溶的金属,如钒、铬、锰等。活泼的金属一般采用电解的方法,电解熔融的氯化钠、氯化镁、氧化铝制取钠、镁、铝。
里把金属还原出来。焦炭、氢气、一氧化碳是常使用的还原剂,方法①、②一般冶炼不活泼或较活泼的金属,如铜、铁等。活泼金属置换法,一般在水溶液中进行,也可以是粉末状。在工业上利用铝热反应,用铝作还原剂冶炼难溶的金属,如钒、铬、锰等。活泼的金属一般采用电解的方法,电解熔融的氯化钠、氯化镁、氧化铝制取钠、镁、铝。
(Ⅰ)孔雀石的主要成分是Cu2(OH)2CO3,加热分解:
Cu2(OH)2CO3 2CuO+H2O+CO2↑
 火烧时,使用的树木变为木炭,CuO再与木炭反应,产生铜,属于焦炭法。
火烧时,使用的树木变为木炭,CuO再与木炭反应,产生铜,属于焦炭法。
C+2CuO 2Cu+CO2↑ 符合①
(Ⅱ)湿法炼铜是我国西汉时期用铁从某些含铜化合物的溶液中置换出铜,属活泼金属置换法。
Fe+CuSO4=Fe SO4+Cu 适合于③
(Ⅲ)是使铝粉和Cr2O3的混合物在高温下反应,置换出铬,反应产生的热量使铬熔化而分离。
 2Al+ Cr2O3 Al2O3
+2Cr 适合于③
2Al+ Cr2O3 Al2O3
+2Cr 适合于③
 (Ⅳ)从光卤石(KCl·MgCl2·6H2O)中可得到六水合氯化镁晶体,再采用通电分解熔融的氯化镁的方法制取镁。
(Ⅳ)从光卤石(KCl·MgCl2·6H2O)中可得到六水合氯化镁晶体,再采用通电分解熔融的氯化镁的方法制取镁。
MgCl2 Mg + C12↑ 符合④
新活题网站
1.C 2.C 3.D
 讲析:1.在元素周期表中,金属与非金属元素分界线附近的金属元素往往表现一定的非金属性,②错;价电子数多少与失电子难易不一致,故③错;铵盐中不含金属元素,故④错。金属晶体中只含阳离子,而不含阴离子。3.硬铝是Al、Cu、Mg、Mn、Si的合金,黄铜是Cu、Zn的合金,钢铁主要是Fe、C合金。水银是金属单质。
讲析:1.在元素周期表中,金属与非金属元素分界线附近的金属元素往往表现一定的非金属性,②错;价电子数多少与失电子难易不一致,故③错;铵盐中不含金属元素,故④错。金属晶体中只含阳离子,而不含阴离子。3.硬铝是Al、Cu、Mg、Mn、Si的合金,黄铜是Cu、Zn的合金,钢铁主要是Fe、C合金。水银是金属单质。
19.有一金属钠投入到盛有100ml氯化镁和氯化铝的混合溶液的烧杯中,发现烧杯中沉淀先多后少,反应完毕后收集到标准状况下的氢气13.44L,同时得到21.4g沉淀。将此沉淀溶于过量苛性钠溶液中,发现沉淀减轻了15.6g。求原混合溶液中Mg2+、Al3+及Cl-的物质的量浓度。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com