
2.炔烃的通式:CnH2n-2
1.炔烃的概念
2.化学性质
(1)氧化反应
a.燃烧
2CH CH+5O2
CH+5O2 4CO2+2H2O
4CO2+2H2O
b.易被酸性KMnO4溶液氧化
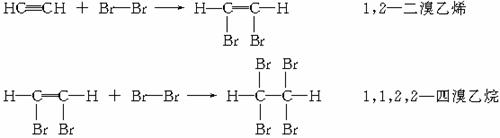
(2)加成反应
1.物理性质
2、分子永不停息的做无规则的热运动:
(1)
(2)
补:(3)扩散运动和布朗运动表明组成物质的分子在不停的运动。
理解布朗运动时应注意:(1)悬浮在液体中的花粉微粒的运动并不是由于液体的流动或外界的扰动引起的,而是由于液体分子对微粒的撞击作用的不平衡引起的。所以布朗运动并不是微粒本身分子的运动,而是间接地反映了液体分子的运动情况。(2)在理解布朗运动中微粒运动位置的连线图时,应明确微粒运动位置的连线并不等同于微粒或液体分子的运动轨迹。这是因为每隔一定的时间把观察到的微粒的位置记录下来后用直线把这些位置依次连接得到的缘故,还因为微粒频繁(每秒约10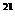 次)受到液体分子的碰撞,所以微粒运动位置的连线图是在大量的无规则运动的液体分子撞击作用下某段时间内的一种宏观平均效果的体现。(3)布朗运动表明:分子间有间隙;分子永不停息的做无规则运动;温度越高,分子的无规则运动越剧烈;微粒越小,周围液体分子对微粒撞击作用的不平衡性就越明显,即布朗运动越显著。
次)受到液体分子的碰撞,所以微粒运动位置的连线图是在大量的无规则运动的液体分子撞击作用下某段时间内的一种宏观平均效果的体现。(3)布朗运动表明:分子间有间隙;分子永不停息的做无规则运动;温度越高,分子的无规则运动越剧烈;微粒越小,周围液体分子对微粒撞击作用的不平衡性就越明显,即布朗运动越显著。
[典型例题]
例1、有人说布朗运动就是分子运动或热运动,这种说法对吗?为什么?
答:这种说法不对,布朗运动是悬浮在液体中的微粒由于受到周围液体分子 对微粒的撞击作用的不平衡而引起的,并不是微粒本身分子的运动。热运动指的是大量分子的无规则运动,布朗运动的剧烈程度能反映液体分子的热运动情况,但布朗运动不能称之为热运动。
例2、关于布朗运动,下述说法中正确的是:
A、温度越高,布朗运动越明显; B、做布朗运动的某个微粒,其速率有可能变慢,最终静止不动; C、布朗运动产生的原因是液体分子在永不停息的无规则运动; D、液体分子的无规则运动就是布朗运动。
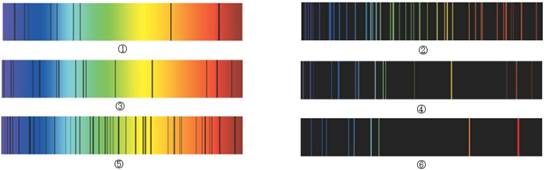
3.光谱:不同元素的原子发生跃迁时会吸收(基态→激发态)和放出(基态→激发态)能量,产生不同的光谱--原子光谱(吸收光谱和发射光谱)。利用光谱分析可以发现新元素或利用特征谱线鉴定元素。
试题枚举
[例1]下列有关电子云和原子轨道的说法正确的是( )
A.原子核外的电子象云雾一样笼罩在原子核周围,故称电子云
B.s能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动
C.p能级的原子轨道呈纺锤形,随着能层的增加,p能级原子轨道也在增多
D.与s电子原子轨道相同,p电子原子轨道的平均半径随能层的增大而增大
解析: 电子云是对电子运动的形象化描述,它仅表示电子在某一区域内出现的概率,并非原子核真被电子云雾所包裹,故选项A错误。原子轨道是电子出现的概率约为90%的空间轮廓,它表明电子在这一区域内出现的机会大,在此区域外出现的机会少,故选项B错误。无论能层序数n怎样变化,每个p能级都是3个原子轨道且相互垂直,故选项C错误。由于按1p、2p、3p……的顺序,电子的能量依次增高,电子在离核更远的区域出现的概率逐渐增大,电子云越来越向更大的空间扩展,原子轨道的平均半径逐渐增大。
答案: D
[例2]下列有关认识正确的是( )
A.各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n-1
D.各能层含有的电子数为2n2
解析:各能层的能级都是从s能级开始,但不是至f能级结束,如L能层只有2s、2p两个能级,B错误;各能层含有的能级数与能层一致,以C不对;各能层最多容纳电子数为2n2,而不是必须含有的电子数2n2
答案:A
[例3]以下电子排布式表示基态原子电子排布的是( )
A.1s22s22p63s13p3 B.1s22s22p63s23p63d104s1 4p1
C.1s22s22p63s23p63d24s1 D.1s22s22p63s23p63d104s2 4p1
解析:A B C均不符合能量最低原理,选D
答案:D
[例4]人们常将在同一原子轨道上运动的,自旋方向相反的2个电子,称为“电子对”;将在同一原子轨道上运动的单个电子,称为“未成对电子”。以下有关主族元素原子的“未成对电子”的说法,错误的是( )
A.核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子”
B.核外电子数为偶数的基态原子,其原子轨道中一定不含“未成对电子”
C.核外电子数为偶数的基态原子,其原子轨道中可能含有“未成对电子”
D.核外电子数为奇数的基态原子,其原子轨道中可能不含“未成对电子”
解析:s p d f 能级所含轨道数分别为1、3、5、7,均为奇数,而电子电子排布在同一能级的各个轨道时,优先占据不同的轨道,如两电子占据2p轨道分别占据两个轨道,形成两个未成对电子
答案: B D
[例5]以下是表示铁原子和铁离子的3种不同化学用语。
|
|
结构示意图 |
电子排布式 |
电子排布图(轨道表示式) |
|
铁原子 |
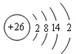 |
1s22s22p63s23p63d64s2 |
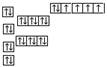 |
|
铁离子 |
 |
1s22s22p63s23p63d5 |
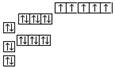 |
⑴铁原子最外层电子数为 ,铁在发生化学反应时,参加反应的电子可能是 。
⑵请你通过比较、归纳,分别说出3种不同化学用语所能反映的粒子结构信息。
答案:⑴2 4s上的2个电子或4s上的2个电子和3d上的1个电子
⑵结构示意图:能直观地反映核内的质子数和核外的电子层数及各能层上的电子数。
电子排布式:能直观地反映核外电子的能层、能级和各能级上的电子数。
轨道表示式:能反映各轨道的能量的高低及各轨道上的电子分布情况,自旋方向。
[例6]下图是锂、氦、汞的吸收光谱和发射光谱。其中图_____________是原子由基态转化为激发态时的光谱,图____________是原子由激发态转化为基态时的光谱。不同元素的原子光谱上的特征谱线不同,请在下图中用线段将同种元素的吸收光谱和发射光谱连接。
2.激发态:较高能量状态(相对基态而言)。如基态原子的电子吸收能量后,电子跃迁至较高能级成为激发态原子。
1.基态:最低能量状态。如处于最低能量状态的原子称为基态原子。
4.洪特规则:电子排布在同一能级的各个轨道时,优先占据 轨道,且自旋方向 。
思考:为什么在同一原子中不可能出现运动状态完全相同的两个电子?
3.泡利原理:每个原子轨道里最多只能容纳 个自旋方向 的电子。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com