
6.下面是一封结婚请柬的主要内容,其中有四处用词不当,请找出来并加以修改。
布朗先生及其夫人:兹定于九月二十九日(星期六)四时在纽约天安教堂为爱女伊丽莎白·史密斯与约翰·弗雷德里克·汉密尔顿先生举行婚礼,届时务必光临。约翰·史密斯夫妇谨订。
(1)将________改为________ (2)将________改为________
(3)将________改为________ (4)将________改为________
[解析] 本题考查语言运用准确、简明、得体的能力。解答此题,一要正确理解词语的含义,二要根据说话对象,考虑用语的得体,特别是谦敬辞的使用,如对自己的“女儿”不能称“爱女”,对别人不能用表命令的“务必”等。
[答案] (1)将“及其”改为“及”;(2)将“四时”改为“下午四时”或“十六时”;(3)将“爱女”改为“小女”;(4)将“务必”改为“恭请”。
5.下列各项中最适合填在横线上的一项是
( )
尊严的具体性不只表现在工作有岗位、生活有保障上,更表现在你可以自由、独立地存在,不会依附于强权,可以建立并实现你的自我价值。这样,________。
A.每个国民才是有尊严的国民,无数个有尊严的国民构成的国家才是真正有尊严的国家,才会真正赢得世界的尊重与敬重
B.国家才是有尊严的国家,每个国民才是有尊严的国民,才会真正赢得世界的尊重与敬重
C.才会赢得世界的尊重与敬重,才使每个国民成为有尊严的国民,国家才是真正有尊严的国家
D.每个国民才是有尊严的国民,才会真正赢得世界的尊重与敬重,国家才会由无数个有尊严的国民构成真正有尊严的国家
[解析] 注意说话的顺序,一般的顺序是由小到大,由国民的尊严到国家的尊严,再到国家受到尊重与敬重。
[答案] A
4.把下列句子组合成语意连贯的一段话,填写在横线上,组合恰当的一组是
( )
__________,__________,__________。__________,________,至今成为梅派的必修课程,也成为梅派京剧里美丽动人的形姿。
①创新了旦角的表现力
②也被梅兰芳演变出了五十三种之多
③梅兰芳摸索出了丰富多样的表演技巧
④就算是最简单的旦角手姿
⑤随着改良创新在众多剧目中的实践
A.⑤③①④② B.⑤③④②①
C.④②⑤③① D.②①⑤④③
[解析] 按照先概述后具体的逻辑顺序排列。⑤③①概括说明梅兰芳在旦角上的创新,④②具体说明他在旦角手姿上的创新。
[答案] A
1.依次填入下面一段文字横线处的语句,衔接最恰当的一组是
( )
没有一个人的生命是完整无缺的,每个人都少了一样东西。______________,仿佛我们背上的一根刺,时时提醒我们要谦卑;要懂得怜恤。
①以前我也痛恨我人生中的缺失 ②你不想要它 ③每个人的生命,都被上苍划上了一道缺口 ④因为我认识到生命中的缺口 ⑤它却如影随形 ⑥但现在我却能宽心接受
A.③②⑤①⑥④ B.③②①⑥④⑤
C.①⑥④③②⑤ D.①⑥②⑤④③
[解析] 解答此题,首先要注意题中横线前后的语句,由横线前的语句,可确定③紧承其后,由横线后的语句,可确定④在其前,由上述两点即可确定答案。
[答案] A
3.常见配平方法
(1)化合价升降法(即电子得失法或氧化数法)
这类方法既可以配平分子反应式,也可以配平离子反应式,它是氧化还原反应的一般配平方法。化合价升降法的配平步骤是:
①写出反应物和生成物的化学式,分别标出变价元素的化合价,得出升降数目。
②使化合价升高与化合价降低的总数相等(求最小公倍数法)。
③用观察的方法配平其它物质的化学计算数(包括部分未被氧化或还原的原子(原子团)数通过观察法增加到有关还原剂或氧化剂的化学计量数上),配平后把单线改成等号。
该基本步骤可简记作:划好价、列变化、求总数、配化学计量数。
例3.由硫可制得多硫化钠Na2Sx,x值一般为2-6,已知Na2Sx与NaClO反应的化学方程式如下:
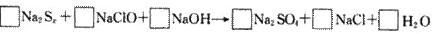
试配平上述方程式,若某多硫化钠在反应中消耗的NaClO和NaOH的物质的量之比为2:1,试以求得的x值写出该多硫化钠的分子式_____________。
解析:本题解答的关键必须正确标出Na2Sx中硫的氧化数(化合价),由化合物中化合价的代数和等于零这一原则得硫的氧化数为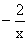 。分析反应前后元素的化合价变化情况,硫元素由
。分析反应前后元素的化合价变化情况,硫元素由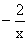 升高到十6价,每个硫原子净升高数为
升高到十6价,每个硫原子净升高数为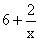 ,x个硫原子共升高6x十2,NaClO中氯元素的化合价由十1价降到-1价,净降低数为2,根据最小公倍数可得Na2Sx前的系数为1,NaClO和NaCl前的系数为3x十1。
,x个硫原子共升高6x十2,NaClO中氯元素的化合价由十1价降到-1价,净降低数为2,根据最小公倍数可得Na2Sx前的系数为1,NaClO和NaCl前的系数为3x十1。 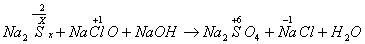 其他物质前面的系数使用观察法配平。根据NaClO和NaOH的物质的量之比为2:1有:(3x十1)/(2x-2)=2,算出x=5。
其他物质前面的系数使用观察法配平。根据NaClO和NaOH的物质的量之比为2:1有:(3x十1)/(2x-2)=2,算出x=5。
答案: 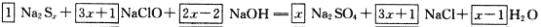 多硫化钠的化学式为Na2S5。
多硫化钠的化学式为Na2S5。
例4. 在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650mg·L-1现用氯氧化法处理,发现如下反应(其中N均为-3价):KCN+2KOH+Cl2=KOCN+2KCl+H2O被氧化的元素是_________。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式,并标出电子转移方向和数目:
KOCN+ KOH+Cl2 →C02+ N2+______KCl+ ______ H2O
解析: (1)在反应KCN+2KOH+C12→KOCN+2KCl+ H20中,碳元素的化合价从+2上升到+4,失电子被氧化。 (2)从:KCN+KOH+C12→CO2+N2+KCl+ H20可知,N、C两元素的化合价从-3、-2分别升至0、+4,而C1元素的化合价从0降至-1,根据氧化还原反应中元素化合价升降数相等的规律,即可配得2KCN+4KOH+3C12→2C02+N2 +6KCl+2H20
答案:(1)碳(或C);(2)2;4、3、2、1、6、2
(2)离子-电子法(半反应法)
此方法是将反应式改写为氧化和还原两个半反应,先将半反应配平,然后将这些半反应加合起来,消去其中的电子,便完成了配平.此类方法比较适用于某些化合物中元素的氧化数比较难于确定的反应方程式,适用于溶液中的氧化还原反应的配平。
例5.配平MnO4-+ C3H7OH→Mn2++C2H5COOH(酸性介质)
解析:任何一个氧化还原反应都是由两个半反应组成的。因此可以将这个方程式分成两个未配平的半反应式,一个代表氧化,一个代表还原。对于此反应可以写成:
MnO4-→Mn2+(还原) C3H7OH→C2H5COOH(氧化)。由于反应在酸性介质中进行,加H+和H2O配平半反应式两端的氢原子数,并使两端电荷数相等:
MnO4-+8H++5e--=Mn2++4H2O①
C3H7OH+H2O= C2H5COOH+4H++4e-②
根据得失电子数必须相等,将两边电子消去,加合成一个已配平的反应式。
①×4+②×5得:4MnO4-+12H++5C3H7OH =4Mn2++5C2H5COOH+11H2O
经检验:配平正确。
(3)自身氧化还原反应方程式的逆向配平法
自身氧化--还原反应是电子转移发生于同一种物质的同一种元素间或同一种物质分子内部不同种元素间的氧化--还原反应。从化学反应方程式的生成物一侧入手,从右向左进行配平。
例如:配平Cl2+KOH--KCl+KClO3+H2O
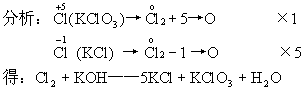
KCl和KClO3系数之和除2,就是Cl2的系数,其余系数再通过观察确定。
即:3Cl2+6KOH  5KCl+KClO3+3H2O
5KCl+KClO3+3H2O
说明:在化合价升降法的基础上采用逆向配平的方法。有助于培养辩证思维,是对传统方法的创新。
2.配平的思路
一般分两部分:第一部分是氧化剂、还原剂、氧化产物、还原产物之间的配平-化合价升降相等或电子得失数相等;第二部分是用观察法配平其他物质的化学计量数。
1.配平的原则
(1)电子守恒:氧化还原反应过程中,氧化剂得电子总数目等于还原剂失电子总数目,即:“电子得失数相等”“化合价升降数相等”。
(2)质量守恒:反应前后各元素的原子个数相等。
(3)电荷守恒:对于离子方程式,等式两边“电荷总数相等”。
原理是:氧化剂得到的电子总数等于还原剂失去的电子总数。
例2.硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水.反应中生成的氧化产物和还原产物的物质的量之比是( )
A.1:3 B.2:3 C.1:1 D.4:3
解析:首先判断氧化产物是氮气,还原产物是二氧化硫。每生成1摩尔氮气需要失去6摩尔电子,每生成1摩尔二氧化硫需要得到2摩尔电子。根据得失电子相等的原理,氧化产物和还原产物的物质的之比应为1:3。
答案:A
说明:解这类题目不必都写出完整并配平的氧化还原反应方程式,关键是抓住本质,厘清得失相等的关系。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com