
5、在一固定体积的密闭容器中加入2 mol A和1 mol B发生反应
 2A(g)+B(g) 3C(g)+D(g),达到平衡时C的浓度为w mol·L-1,若维持容器的体积和温度不变,按下列四种配比方案作为反应物,达平衡后,使C的浓度仍为w mol·L-1的配比是( )
2A(g)+B(g) 3C(g)+D(g),达到平衡时C的浓度为w mol·L-1,若维持容器的体积和温度不变,按下列四种配比方案作为反应物,达平衡后,使C的浓度仍为w mol·L-1的配比是( )
A.4 mol A+2 mol B B.3 mol C+1 mol D+2mol A+1 mol B
C.3mol C+1 mol D+1 mol B D.3 mol C+1 mol D
4.在某温度下,在一容积可变的容器中,反应2A(g)+B(g)  2C(g)达平衡时,A、B和C的物质的量分别为4mol、2mol、4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
2C(g)达平衡时,A、B和C的物质的量分别为4mol、2mol、4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A均减半 B 均加倍 C 均增加1mol D 均减少1mol
3. 在体积固定的密闭容器中充入3molA和1mol
B发生反应3A(g)+B(g)  xC(g),达平衡后C在平衡混合气中的体积分数为w,若维持温度和体积不变,按1.2molA、0.4molB、0.6molC为起始物质,达到平衡后,C的体积分数仍为w,则x值是( )
xC(g),达平衡后C在平衡混合气中的体积分数为w,若维持温度和体积不变,按1.2molA、0.4molB、0.6molC为起始物质,达到平衡后,C的体积分数仍为w,则x值是( )
A. 1 B. 2 C. 3 D. 4
2.高温高压和使用催化剂的条件下,在密闭容器中发生如下反应: CO(g)+2H2(g) CH3OH(g),若开始时只充入amol CH3OH气体,达到平衡时,混合物的压强比起始时增大了70%;若开始时充入amol CO和2amol H2的混合气体,达到平衡时H2转化率为( )
CH3OH(g),若开始时只充入amol CH3OH气体,达到平衡时,混合物的压强比起始时增大了70%;若开始时充入amol CO和2amol H2的混合气体,达到平衡时H2转化率为( )
A.30% B.35% C.65% D.70%
规律一:恒温恒容条件下,对于反应前后气体分子数改变的反应,只改变起始时加入物质的物质的量,通过可逆反应的化学计量数比换算成同一半边的物质的物质的量(即把一边“归零”),与原平衡相等,则两平衡等效。
2SO2(g)+O2(g)
 2SO3(g)
2SO3(g)
途径1起始 2mol 1mol 0
途径2起始 0 0 2mol
途径3起始 1mol 0.5mol 1mol
途径4起始 0.5mol ? ?
途径5起始 amol bmol cmol
[问题]: ①途径2、 3与1等效吗?
②途径4 中O2(g) 和 SO3(g)的起始量为多少, 平衡时可与途径1平衡时SO3(g)的含量相同?
③途径5中a、b符合怎样的关系达到的平衡状态与1相同?
[例2]恒温恒容时,判断哪些是等效平衡? ( A B D )
 N2 + 3H2 2NH3
N2 + 3H2 2NH3
A.2mol 6mol 0mol
B. 0mol 0mol 4mol
C. 0.5mol 1.5mol 1mol
D. 1mol 3mol 2mol
[例3].将2molSO2(g)和2molSO3(g)混合于某固定体积的容器中,在一定条件下达平衡。平衡时SO3(g)为wmol,同温下,分别按下列配比在相同体积的容器中反应,达平衡时SO3(g)的物质的量仍为wmol的是( )
A 2molSO2(g)+1mol O2(g)
B 4mol SO2(g)+ 1mol O2(g)
C 2mol SO2(g)+ 1mol O2(g)+ 2mol SO3(g)
D 3mol SO2(g)+1.5mol O2(g)+ 1mol SO3(g)
[例4]在一个固定容积的密闭容器中加入2molA和1molB,发生反应2A(g)+B(g)≒3C(g)+D(g),达到平衡时,C的浓度为wmol/L。若维持容器的容积和温度不变,按下列情况配比为开始浓度,达到平衡后C的浓度仍为wmol/L的是( )
A、4molA+2molB
B、2molA+1molB+3molC+1molD
C、3molC+1molD+1molB
D、3molC+1molD
E、1molA+0.5molB+1.5molC+0.5molD
规律二:在恒温恒容条件下,对于反应前后气体分子数不变的可逆反应,通过可逆反应的化学计量数比换算成同一半边的物质的物质的量(即把一边“归零”),与原平衡相等只要反应物(或生成物)的物质的量的比例与原平衡相同,两平衡等效。
[例1] 在定温定容条件下,发生如下反应
H2(g)+I2(g)  2HI(g)
2HI(g)
途径1 1 mol 1mol 0
途径2 0mol 0 2mol
途径3 2mol 2mol 0
途径4 0mol 0mol 4mol
上述途径与1是否等效?
[讲述]:途径3可认为是同温同容时两个途径1,每个都与1等效然后加压平衡不移动,所以与1等效(见图)

|
|
|
|
恒温恒容,发生反应 H2(g)+I2(g)  2HI(g)
2HI(g)
途径1 2 mol 1mol 0
途径2 1mol 0 1mol
途径3 4mol 2mol 0
途径4 3mol 1mol 2mol
上面与途径1等效的有________________
[例2]将装有1molHI的容器密封并加热,部分HI分解成H2和I2(g)并达到化学平衡。此时I2(g)的体积分数为x%,若在该容器中加入2molHI后密封,加热到相同温度使之达到平衡,设此时I2的体积分数为y%,则x与y的关系为( )。
A. 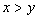 B.
B. 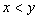 C.
C. 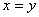 D.
D. 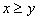
规律三:在恒温恒压时,此时各不相同的起始状态,也可以把一边“归零”换算成同一半边,只要各物质的物质的量之比相同,则两平衡等效可以把一边“归零”换算成同一半边,只要各物质的物质的量之比相同,则两平衡等效
[例1]如果定温定压条件下,
2SO2(g)
+ O2(g)  2SO3(g)
2SO3(g)
途径1起始 2mol 1mol 0
途径2起始 4 mol 2 mol 0
途径1和2是否为等效平衡?
|
|
|
若反应为:H2(g)+
I2(g)  2HI(g)
2HI(g)
途径1 2 mol 1mol 0
途径2 4mol 2mol 0
|
|
|
同步练习
1.可逆反应A(g)+B(g)  2C(g),在固定容积的容器中进行。若向容器中充入1molA和1mol B,在某温度下达到平衡时,C的体积分数为n%,若向容器中充入2molA和3mol B,在某温度下达到平衡时,C的体积分数为m%则m和n的正确关系为 (
)
2C(g),在固定容积的容器中进行。若向容器中充入1molA和1mol B,在某温度下达到平衡时,C的体积分数为n%,若向容器中充入2molA和3mol B,在某温度下达到平衡时,C的体积分数为m%则m和n的正确关系为 (
)
A . m>n B. m<n C . m=n D. 无法比较
[引言]一定温度下密闭容器中发生反应:1L容器800℃时可逆反应
CO(g) + H2O(g)  CO2(g)+ H2(g)
CO2(g)+ H2(g)
途径1:起始 0.01mol 0.01mol 0 0
平衡 0.004mol 0.004mol 0.006mol 0.006mol
途径2:起始 0 0 0.01mol 0.01mol
平衡 0.004mol 0.004mol 0.006mol 0.006mol
上述两种途径,同一可逆反应;外界条件相同;通过不同的途径(正向和逆向);平衡时同种物质的物质的量相等(同种物质的含量相等)-----效果相同的平衡
对于同一个可逆反应,在相同的条件下(恒温恒容或恒温恒压),不管是从正反应开始,还是从逆反应开始,或从正反应和逆反应同时开始,都可以建立同一平衡状态。即化学平衡状态与条件有关,而与建立平衡的途径无关
等效平衡: 同一可逆反应当外界条件一定时,反应无论从正反应开始还是从逆反应开始,平衡时平衡混合物中同种物质的含量(体积分数或物质的量分数)相同的状态.
15.(16分)冰壶比赛是在水平冰面上进行的体育项目,比赛场地示意如图所示,比赛时,运动员在投掷线AB 处让冰壶以v0=2m/s的初速度向圆垒圆心O点滑出,已知圆垒圆心O到AB线的距离为30m,冰壶与冰面间的动摩擦因数为 (g取
(g取 )
)
(1)如果在圆垒圆心O有对方的冰壶,为了将对方冰壶撞开,运动员可以用毛刷擦冰壶运行前方的冰面,使冰壶与冰面间的动摩擦力因数减小,若用毛刷擦冰面后动摩擦因数减少至 ,则运动员用毛刷擦冰面的长度应大于多少米?
,则运动员用毛刷擦冰面的长度应大于多少米?
(2)若运动员采用擦刷冰面的方式使冰壶刚好运动到圆垒圆心O点处,那么冰壶运动的最短时间是多少?
14.(16分)如图所示,一个质量为 的带正电微粒,重力可忽略不计,从静止开始经电压U1=100V的电场加速后,水平进入两平行金属板间的偏转电场,偏转电场的电压U2=100V,金属板长L=20cm,两板间距
的带正电微粒,重力可忽略不计,从静止开始经电压U1=100V的电场加速后,水平进入两平行金属板间的偏转电场,偏转电场的电压U2=100V,金属板长L=20cm,两板间距 (可认为两板间电场为匀强电场,并忽略边缘效应)求:
(可认为两板间电场为匀强电场,并忽略边缘效应)求:
(1)微粒进入偏转电场时的速度v0大小;
(2)微粒射出偏转电场时的偏转角 ;
;
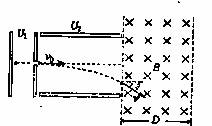 (3)若该匀强磁场的宽度为D=10cm的有界磁场,为使微粒垂直于磁场右边界射出,该匀强磁场的磁感应强度B是多大?
(3)若该匀强磁场的宽度为D=10cm的有界磁场,为使微粒垂直于磁场右边界射出,该匀强磁场的磁感应强度B是多大?
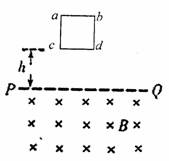
13.(15分)如图所示,质量为m、电阻为r,边长为L的正方形导线框abcd,其下边cd距匀强磁场上边界PQ的距离为h。磁感应强度大小为B,方向垂直于纸面向里,现使线框从静止开始自由下落,下落过程中ab边始终水平,不计空气阻力,重力加速度为g。
(1)如果线框进入磁场时先做加速运动,那么线框刚进入磁场里加速度大小是多少;
(2)如果ab边进入磁场前线框速度已达到稳定,那么线框在进入磁场的过程中产生的热量是多少。
12.[选做题]本题包括A、B、C三小题,请选定其中两题,并在相应答题区域内作答。若
三题都做,则按A、B两题评分。
A.(选修3-3模块)(12分)
(1)(4分)以下说法中正确的是
A.被活塞封闭在空缸中的一定质量的理想气体,若体积不变,压强增大,则气缸
在单位面积上,单位时间内受到的分子碰撞次数增加
B.布朗运动是悬浮在液体中固体颗粒的分子无规则运动的反映
C.分子间距增大,分子势能就一定增大
D.用力拉铁棒的两端,铁棒没有断,这是分子间存在吸引力的宏观表现
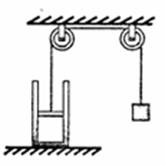 (2)(4分)如图所示,气缸内封闭一定质量的某种理想气体,活塞
(2)(4分)如图所示,气缸内封闭一定质量的某种理想气体,活塞
通过滑轮和一重物连接并保持平衡,已知活塞距缸口0.2m,活
塞面积10 ,大气压强
,大气压强 ,物重50N,活塞质量及
,物重50N,活塞质量及
一切摩擦不计,缓慢升高环境温度,使活塞刚好升到缸口,封闭
气体吸收了60J的热量,则封闭气体的压强将 (选填“增加”、
“减小”或“不变”),气体内能变化量为 J。
(3)(4分)一滴体积为V的油酸,配制成体积比为1:k的油酸溶液( ),现取一滴体积仍为V的油酸溶液在滴在水面上,在水面上形成面积为S的单分子油膜,已知油酸的密度为
),现取一滴体积仍为V的油酸溶液在滴在水面上,在水面上形成面积为S的单分子油膜,已知油酸的密度为 ,摩尔质量为M。请据此推算阿伏伽德罗常数的表达式。
,摩尔质量为M。请据此推算阿伏伽德罗常数的表达式。
B.(选修3-4模块)(12分)
(1)下列说法中正确的有
A.不管光源与观察者是否存在相对运动,观察者观察到的光速是不变的
B.水面上的油膜呈现彩色是光的干涉现象
C.日落时分,拍摄水面下的景物,在照相机镜头前装上偏振光片可以使像更清晰
D.声源向静止的观察者运动,观察者接收到的频率小于声源的频率
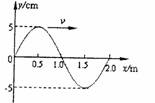 (2)如图所示是一列沿x轴正方向传播的简谐横波在
(2)如图所示是一列沿x轴正方向传播的简谐横波在
t=0时刻的波形图,已知波的传播速度 ,
,
则 处质点在1s时的位移为
cm,x=1m
处质点在1s时的位移为
cm,x=1m
处的质点做简谐运动的表达式y= cm。
(3)直角玻璃三棱镜的截面如图所示,一条光线从AB
面入射,ab为其折射光线,图中 。已知这种玻璃的折射率
。已知这种玻璃的折射率 试求:
试求:
①ab光线在AC面上有无折射光线?(要有论证过程)
②ab光线经AC面反射后,再经BC面折射后的光线与BC面的夹角。
C.(选修模块3-5)(12分)
(1)(4分)下列说法正确的是
A.康普顿效应进一步证实了光的波动特性
B.为了解释黑体辐射规律,普朗克提出电磁辐射的能量的量子化
C.经典物理学不能解释原子的稳定性和原子光谱的分立特征
D.天然放射性元素的半衰期与环境的温度有关
(2) 是不稳定的,能自发地发生衰变。
是不稳定的,能自发地发生衰变。
①完成 衰变反应方程
衰变反应方程 。
。
② 衰变为
衰变为 ,共经过
次
,共经过
次 衰变,
次
衰变,
次 衰变。
衰变。
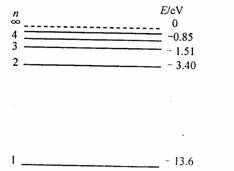
(3)氢原子的能级如图所示,有一群处于n=4能级的氢原子。如果原子n=2向n=1跃迁所发生的光正好使某种金属材料产生光电效应,则:
①这群氢原子发出的光谱中共有几条谱线能使该金属产生光电效应?
②从能级n=4向n=1发出的光照射该金属材料,所产生的光电子的最大初动能为多少?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com