
本章内容是有机化学的基础,是历年高考的内容之一,近几年来有日趋强化之势。其主要热点有:①几种烃的代表物的分子结构及性质;②利用燃烧通式对有机物的分子组成和结构式进行推断;③烃及其卤代烃的同分异构体的书写;④有机物分子的空间结构分析;⑤石油化工与煤化工等。由于本章的知识点与能源、交通、医疗、工农业生产、科技、环境保护、生态平衡联系密切,与此相关的试题有逐年增加的趋向。
[例题](2002年春上海,66)科学家致力于二氧化碳的“组合转化”技术研究,把过多的二氧化碳转化为有益于人类的物质。如将CO2和H2以1∶4的比例混合,通入反应器。在适当的条件下反应,可获得一种重要的能源。请完成以下化学方程式:
CO2+4H2 ( )+2H2O
( )+2H2O
若将CO2与H2混合,在一定条件下以1∶3的比例发生反应,生成某种重要的化工原料和水。该化工原料可能是
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
解析:从原子守恒的角度去分析,1 mol CO2与4 mol H2反应时,生成了2 mol H2O,生成的另一物质中必有1 mol C和4 mol H,由方程式的计量数可知,此物质必为CH4。同理可知,CO2与H2按物质的量之比1∶3混合,生成水外,另一物质的最简式为CH2,也只能为烯烃。
答案:CH4 B
6.求有机物化学式的规律
研究物质的组成是化学研究的重要任务之一,而通过计算求出有机物的化学式则是高中学生必须熟练掌握的基本技能。
(1)求有机物化学式的一般方法
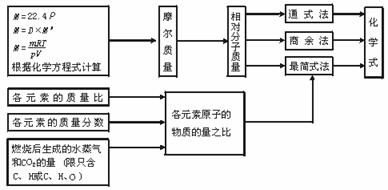
式中:ρ-气体标况下密度;D-气体的相对密度;M ′-已知气体的相对分子质量。
(注:商余法只适用于求烃的化学式)
(2)有关烃的混合物计算的几条规律。
①若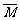 <26(烷、炔相混),则一定有CH4。
<26(烷、炔相混),则一定有CH4。
②若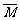 <28(烷、烯相混),则一定有CH4。
<28(烷、烯相混),则一定有CH4。
③若平均分子组成中,1<n(C)<2,则一定有CH4。
④若平均分子组成中,2<n(H)<4,则一定有C2H2。
⑤两种烃组成的混合气体,若其平均分子组成为n(C)=2,且其中一种分子含两个碳原子,则另一种气体分子一定也含两个碳原子。
5.不饱和度及其应用的规律
不饱和度又名“缺氧指数”,用希腊字母Ω表示。顾名思义,不饱和度是反映有机物分子不饱和程度的量化标志。由于烷烃分子饱和程度最大,就规定其Ω=0,而其他有机物,如烃可以这样推算:烃分子中每增加一个碳碳双键或一个环,氢原子数就减少2个,其不饱和度就增加1;每增加一个碳碳叁键,氢原子数就减少4个,其不饱和度就增加2。
烃及其含氧衍生物的不饱和度计算公式为:
不饱和度(Ω)=双键数+环数+叁键数×2。
常见的烃分子和烃基的不饱和度如下:
①烷烃(如CH3CH3),Ω=0;
②烷烃基(如CH3CH3-),Ω=0;
③烯烃如CH2==CH2,Ω=1;
④烯烃基如CH2==CH-,Ω=1;

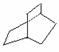
⑦ ,Ω=2;
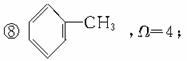
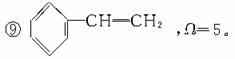
不饱和度公式的主要用途:
(1)可辅助推导化学式。
(2)可辅助判断同分异构体。
(3)可辅助推断分子结构中的结构单元。
4.烃类完全燃烧的规律
(1)燃烧前后气体体积变化规律。
①若生成的水为气态时,根据反应式:
CxHy+(x+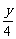 )O2
)O2 xCO2+
xCO2+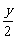 H2O(g)
H2O(g)
ΔV=V后-V前=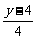 。
。
当y=4时,ΔV=0;当y>4时,ΔV>0;当y<4时,ΔV<0。
②若生成的水为液态时,则不论气态烃所含氢原子数多少,总是ΔV<0。
(2)完全燃烧时的耗氧量规律。
①等物质的量的烃完全燃烧时,其耗氧量的大小取决于(x+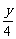 )的值,其值越大,耗氧量越多。
)的值,其值越大,耗氧量越多。
②等质量的烃完全燃烧时,其耗氧量大小取决于该烃分子中氢的质量分数(或氢原子数与碳原子数的比值),其值越大,耗氧量越多。
此规律的证明如下:
设烃的质量为m,含氢的质量分数为w。由关系式C-O2-CO2及4H-O2-2H2O可知该烃耗氧量为:
n(O2)=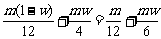 。
。
显然,当m为定值时,w值越大,消耗O2的物质的量就越多。
由此规律还可得出以下推论:
(Ⅰ)等质量的烷烃,碳原子数越多,氢的质量分数越小,耗氧量越少。由此可知CH4耗氧量最多。
(Ⅱ)等质量的单烯烃(或环烷烃),因其碳、氢原子个数比为定值,故氢的质量分数亦为定值,即耗氧量相等。
(Ⅲ)等质量的炔烃(或二烯烃),碳原子数越多,氢的质量分数越大,耗氧量越多。由此可知C2H2耗氧量最少。
(Ⅳ)等质量的苯及苯的同系物,碳原子数越多,氢的质量分数越大,耗氧量越大,由此可知C6H6的耗氧量最少。
(Ⅴ)等质量的烷、烯、炔,因为氢的质量分数: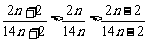 ,故耗氧量为:烷>烯>炔。
,故耗氧量为:烷>烯>炔。
③最简式相同的烃,不论它们以何种比例相混合,只要总质量一定,完全燃烧时所消耗的O2以及燃烧后生成的CO2和H2O的量均为定值。满足上述条件的烃有C2H2与C6H6;烯烃与烯烃(如乙烯与丙烯)或烯烃与环烷烃(如乙烯与环丙烷)等。
3.同分异构体规律
(1)种类。
①碳链异构。因碳原子的结合顺序不同而引起的异构现象。
②位置异构。因官能团或取代基在碳链或碳环上的位置不同而引起的异构现象。
③官能团异构(又称类别异构)。因官能团不同而引起的同分异构现象。
④其他类型(如顺反异构和旋光异构,中学教材未做介绍,但有时会以信息给予题的形式出现)。
(2)同分异构体的书写方法规律
①判类别:据有机物的分子组成判定其可能的类别异构(一般用通式判断)。
②写碳链:据有机物的类别异构写出各类异构的可能的碳链结构(先写最长的碳链,依次写出少一个碳原子的碳链,把余下的碳原子挂到相应的碳链上去)。
③移官位:一般是先写出不带官能团的烃的同分异构体,然后在各条碳链上依次移动官能团的位置,有两个或两个以上的官能团时,先上一个官能团,依次上第二个官能团,依此类推。
④氢饱和:按“碳四键”的原理,碳原子剩余的价键用氢原子去饱和,就可得所有同分异构体的结构简式。
(3)一元取代物的同分异构体数目的判断。
有机物分子中,位置等同的氢原子叫等效氢,显然有多少种等效氢,其一元取代物就有多少种。这种通过等效氢来确定一元取代物同分异构体数目的方法,叫等效氢法。
等效氢的判断方法是:
①同一个碳原子上的氢原子是等效的。
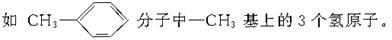
②同一分子中处于轴对称位置或镜面对称位置上的氢原子是等效的。
 轴,故有两类等效氢。
轴,故有两类等效氢。
2.烷烃命名的规律
烷烃的命名是烃类命名的基础,其方法在教材中已做介绍。同学们在应用时特别要注意:
(1)5个原则。
①最长原则:应选最长的碳链做主链;
②最近原则:应从离支链最近一端对主链碳原子编号;
③最多原则:若存在多条等长主链时,应选择含支链较多的碳链做主链;
④最小原则:若相同的支链距主链两端等长时,应以支链位号之和为最小的原则,对主链碳原子编号;
⑤最简原则:若不同的支链距主链两端等长时,应从靠近简单支链的一端对主链碳原子编号。
(2)5个必须。
①取代基的位号必须用阿拉伯数字“2,3,4,…”表示;
②相同取代基的个数,必须用中文数字“二、三、四,…”表示;
③位号2,3,4等相邻时,必须用逗号“,”表示(不能用顿号“、”);
④名称中凡阿拉伯数字与汉字相邻时,必须用短线“-”隔开;
⑤若有多种取代基,不管其位号大小如何,都必须把简单的写在前面,复杂的写在后面。
以上(烷烃的系统命名法)可以概括为:
选主链,称某烷;编位号,定支链;取代基,写在前,注位置,短线连;不同基,简到繁,相同基,合并算。
本章的一些基本概念、基本反应类型、分子结构与性质的关系及某些思维方法是学习有机化学的基础。其主要的基础知识和相关规律如下:
1.烃的分类、结构与性质规律
烃的分类主要依据是:烃的分子结构特点,即碳链、碳环、碳键等。常见的烃类有烷烃(或饱和链烃CnH2n+2),烯烃(CnH2n),炔烃(CnH2n-2),芳香烃(苯的同系物CnH2n-6)等。
烷烃分子中各原子均以单键结合,性质稳定,不与强酸、强碱、强氧化剂反应。烯烃、炔烃分子中含有C==C键或C≡键,因而易发生加成、氧化和加聚反应等。而苯分子中碳碳键是介于单键与双键之间的独特键,因而既能发生取代又能发生加成反应,但不能使溴水和KMnO4溶液褪色。在苯环的影响下,苯的同系物侧链易被氧化而使酸性KMnO4褪色。
31.答案:33
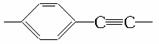
解析: 结构单元中C、H原子个数为C8H4,B中的碳比A中
多1398-1134=264 B中的氢比A中多1278-1146=132 264÷8=33 132÷4=33。
●命题趋向与应试策略
0.500 mol×(16×0.800+28×0.150+30×0.0500) g·mol-1=9.25 g;
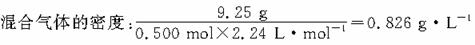
(2)设反应前CH4为1 mol,其中有x mol转化生成C2H4,即生成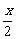 mol C2H4和
mol C2H4和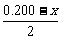 mol C2H6。则反应后混合气体的总物质的量为(0.800+
mol C2H6。则反应后混合气体的总物质的量为(0.800+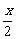 +
+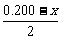 )mol=0.900 mol
)mol=0.900 mol
由密度条件得:
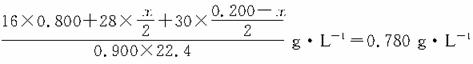
解得x=0.0800?
C2H4的体积分数为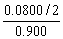 ×100%=4.44%。
×100%=4.44%。
30.答案:(1)9.25 g 0.826 g·L-1 (2)4.44%
解析:(1)0.500 mol混合气体的质量:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com