
8.(2009·江西联考)过点P(1,1)作一直线与抛物线y=x2交于A、B两点,过A、B两点分别作抛物线y=x2的切线,设两切线的交点为M,则点M的轨迹方程为( )
A.y=x2 B.x2+y2=1
C.x2-y2=1 D.x-y-1=0
答案:D
解析:设过点P(1,1)的直线方程为y=k(x-1)+1,代入抛物线方程y=x2并整理得,x2-2kx+2k-2=0,设A(x1,y1),B(x2,y2),由根与系数的关系得x1+x2=2k,x1x2=2k-2;又y′=x,所以过A、B两点的切线斜率分别为k1=x1,k2=x2,过A、B两点的切线方程分别为y=x1(x-x1)+y1,y=x2(x-x2)+y2,设M的坐标为(x,y),所以点M的坐标满足,消去参数k得x-y-1=0,选择D.
7.(2009·郑州市二测)设向量i、j为直角坐标系的x轴、y轴正方向上的单位向量,若向量a=(x+1)i+yj,b=(x-1)i+yj,且|a|-|b|=1,则满足上述条件的点P(x,y)的轨迹方程是( )
A.-=1(y≥0) B.-=1(x≥0)
C.-=1(y≥0) D.-=1(x≥0)
答案:B
解析:依题意,向量a=(x+1,y),b=(x-1,y),又|a|-|b|=1,所以-=1,整理得-=1(x≥0),选择B.
6.(2008·潍坊模拟)一圆形纸片的圆心为O,点Q是圆内异于O的一个定点,点A是圆周上一动点,把纸片折叠使点A与点Q重合,然后抹平纸片,折痕CD与OA交于点P,当点A运动时,点P的轨迹为( )
A.椭圆 B.双曲线
C.抛物线 D.圆
答案:A.
解析:∵折痕所在的直线是AQ的垂直平分线,
∴|PA|=|PQ|,又∵|PA|+|OP|=r,
∴|PQ|+|OP|=r>|OQ|,
由椭圆的定义知点P的轨迹是椭圆.故选A.
5.(2008·成都质检)F1、F2是椭圆的两个焦点,M是椭圆上任一点,从任一焦点向△F1MF2顶点M的外角平分线引垂线,垂足为P,则P点的轨迹为( )
A.圆 B.椭圆
C.双曲线 D.抛物线
答案:A
解析:
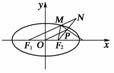
如右图所示,延长F2P到N使|NP|=|F2P|,
则|MF2|=|MN|.∴|NF1|=2a,即|PO|=a.故选A.
4.平面直角坐标系中,已知两点A(3,1),B(-1,3),若点C满足=λ1+λ2(O为原点),其中λ1,λ2∈R,且λ1+λ2=1,则点C的轨迹是( )
A.直线 B.椭圆
C.圆 D.双曲线
答案:A
解析:设C(x,y),由已知得(x,y)=λ1(3,1)+λ2(-1,3),
∴,又λ1+λ2=1.消去λ1,λ2得,x+2y=5.故选A.
3.长为3的线段AB的端点A、B分别在x轴、y轴上移动,=2,则点C的轨迹是( )
A.线段 B.圆
C.椭圆 D.双曲线
答案:C
解析:设C(x,y),A(a,0),B(0,b),则a2+b2=9①
又=2,所以(x-a,y)=2(-x,b-y),
即,②
代入①式整理可得x2+=1.故选C.
2.已知两定点A(-2,0),B(1,0),如果动点P满足|PA|=2|PB|,则点P的轨迹所包围的图形的面积等于( )
A.π B.4π
C.8π D.9π
答案:B
解析:设P(x,y),由题知有:(x+2)2+y2=4[(x-1)2+y2],整理得x2-4x+y2=0,配方得(x-2)2+y2=4.可知圆的面积为4π.故选B.
1.方程x2+y2=1(xy<0)的曲线形状是( )
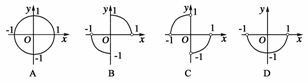
答案:C
解析:方程x2+y2=1表示以原点为圆心,半径为1的单位圆,而约束条件xy<0则表明单位圆上点的横、纵坐标异号,即单位圆位于第二或第四象限的部分.故选C.
14. 黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)上述冶炼过程中产生大量SO2。下列处理方案合理的是 (填代号)。
a.高空排放
b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3
d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:
S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程。 、 (不必配平)。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、AI2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得。
据以上信息回答下列问题:
a.除去Al3+的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 。证明炉渣中含有的实验现象为
。
13. 含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是 ( )
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+ Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
[答案]B
[解析]由于Fe2+的还原性强于 ,故根据氧化还原反应的先后顺序知,Cl2先氧化Fe2+,然后再氧化
,故根据氧化还原反应的先后顺序知,Cl2先氧化Fe2+,然后再氧化 。2Fe2+ + Cl2
。2Fe2+ + Cl2
 2Fe3+ + 2
2Fe3+ + 2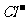 ,2
,2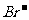 + Cl2
+ Cl2  Br2 + 2
Br2 + 2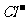 ,2FeBr2 + 3Cl2
,2FeBr2 + 3Cl2  2FeCl3 + 2Br2 。当x/a ≤0.5时,Cl2仅氧化Fe2+,故A项正确21世纪教育网
2FeCl3 + 2Br2 。当x/a ≤0.5时,Cl2仅氧化Fe2+,故A项正确21世纪教育网
当x/a ≥1.5时,Fe2+和Br-合部被氧化,D项正确;
当介于两者之间时,则要分步书写方程式,然后进行叠加得总反应。如B项,当x=0.5a时,Cl2刚好把Fe2+全部氧化,而当x=0.6a,显然Cl2还要氧化Br-,而选项中没有表示,故错。
[考点分析]氧化性强弱比较氧化还原反应的相关计算21世纪教育网
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com