
15、熵、熵增、熵、气态、液、固
1、A、2、C、3、D、4、A、5、BD、6、D、7、A、8、C、9、BC、10、D、11、A、12、C、
16、将N2和H2按体积比为1∶4混合,取0.5mol这种混合气体充入一固定容积的密闭容器中使之发生反应并在一定条件下达到化学平衡,测得平衡后容器内的压强是相同条件下起始时压强的0.76倍。求
(1)达平衡时混合气体中NH3的体积分数
(2)求平衡时N2的转化率
第32讲 化学反应进行的方向及化学平衡计算
15、在298 K时,下列反应的ΔH依次为:
C2H5OH(l) +3O2(g)→2CO2(g) + 3H2O(l);△H1 = -1366.8 kJ. mol-1
C(石墨) + O2(g) → CO2(g); △H2 = -393.5 kJ. mol-1
H2(g) + 1/2O2(g) →H2O(l); △H3 = -285.8kJ. mol-1
乙醇(C2H5OH)、氢气、石墨和氧气的熵值分别为:161.0、130.6、5.74、205.3 J·mol-1·K-1,则298K时,由单质生成1 mol乙醇的ΔH、ΔS及ΔG分别为多少?
14、 (2007年高考理综宁夏卷)氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:□SiO2+□C+□N2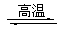 □Si3N4+□CO
□Si3N4+□CO
(1) 配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应中的氧化剂是__________,其还原产物是_____________。
(3)该反应的平衡常数表达式为K =_______________________;
(4)将知上述反应为放热反应,则其反应热DH________零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值________(填“增大”、“减小”或“不变”);
(5)若使压强增大,则上述平衡向_______反应方向移动(填“正”或“逆”);
(6)若已知CO生成速率为v (CO) =18 mol/(L·min),则N2消耗速率为v (N2) =__________mol/(L·min)。
13.在与外界隔离的体系中,自发过程将导致体系的 增大,这个原理也叫做 原理。在用来判断过程的方向时,就称为 判据。不难理解,即使是同一物质,应该存在着 时的熵值最大, 时次之, 时最小的这样一种普遍规律。
12.下列关于化学反应的熵变的叙述正确的是 ( )
A.化学反应的熵变与反应的方向无关 B.化学反应的熵变直接决定了反应的方向
C.熵值增大的反应都是混乱度增大的反应 D.熵值增大的反应都能自发进行
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
11.碳酸铵[(NH4)2CO3]在室温下就能自发地分解产生氨气,对其说法中正确的是( )
A.其分解是因为生成了易挥发的气体,使体系的熵增大 B.其分解是因为外界给予了能量
C.其分解是吸热反应,据能量判据不能自发分解 D.碳酸盐都不稳定,都能自发分解
10.250℃和1.01×105Pa时,反应 2N2O5(g)=4NO2(g)+O2(g);△H=+56.76kJ/mol,自发进行的原因
A.是吸热反应 B.是放热反应 C.是熵减少的反应 D.熵增大效应大于能量效应。
9.已知石墨、金刚石燃烧的热化学方程式分别为C(石墨、s)+ O2(g)= CO2(g) ΔH2= -393.5kJ/mol,C(金刚石、s)+ O2(g)= CO2(g) ΔH2= -395.4kJ/mol。关于石墨和金刚石的相互转化,下列说法正确的是 ( )
A.石墨转化成金刚石是自发进行的过程 B.金刚石转化石墨成金刚石是自发进行的过程
C.相同质量时,石墨比金刚石能量低 D.相同质量时,金刚石比石墨能量低
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com