
3、My English-Chinese dictionary has disappeared.Who have taken it?
A、should B、must C、could D、would
2、----The room is so dirty. we clean it?
----Of course.
A、Will B、Shall C、Would D、Do
1、I often see lights in that empty house.Do you think I report it to the police?
A、should B、may C、will D、can
21.(12 分)已知T、X、Y、Z是中学化学常见的四种元素,其结构或性质信息如下表。
|
元素 |
结构或性质信息 |
|
T |
原子的L层上s电子数等于p电子数。 |
|
X |
元素的原子半径是第三周期主族元素中最大的。 |
|
Y |
空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的。 |
|
Z |
单质常温、常压下是气体。原子的M层上有1个未成对的p电子。 |
请根据信息回答有关问题:
(1)写出与Y2互为等电子体的分子式 。
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是 。
(3)T、X、Y三种元素的电负性由大到小的顺序(填元素符号)是 。
(4)元素Q的原子序数是X与Z的原子序数之和。
①该元素基态原子的最外层电子排布式为 。
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4] 2-,其中T与Y、Q与Z成键时中心原子采用的杂化方式分别是 。
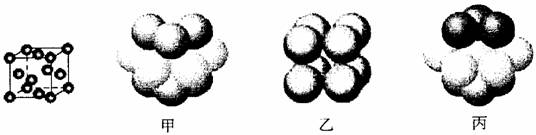
③元素Q形成的单质的晶体结构如左下图所示,该晶体形成时的原子堆积方式是 (选填“甲”、“乙”、“丙”)。


20.(6分)Fe 、Co等原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。
(1)与Fe 、Co原子或离子形成配合物的分子或离子,所具备的结构特征是 。
(2)向黄色的FeCl3溶液加入无色的KSCN溶液,溶液变成血红色:FeCl3+3KSCN===Fe(SCN)3 +3KCl。
向上述血红色溶液中加入NaF溶液振荡,只观察到血红色溶液迅速褪成无色,发生该现象的可能原因是 。
(3)无水CoCl2为深蓝色,吸水后变为粉红色的水化物(CoCl2·XH2O),水化物受热后又变成无水CoCl2,故常在实验室中用作吸湿剂和空气湿度指示剂。现有65 g无水CoCl2吸水后变成119 g CoCl2·XH2O。经测定该化合物中Co2+配位数为6,lmo1 CoCl2·XH2O溶于水后,滴加硝酸银溶液,析出1 mo1 AgCl沉淀。则CoCl2·XH2O的化学式用配合物的形式可表示为 。
19.(14分)海水是人类的宝贵资源。某化工厂拟从海水中提取以下几种化工原料。
(1)制取氯化钠,并生产烧碱和氯气。
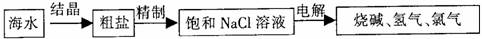
粗盐(含Ca2+、Mg2+、SO42一等杂质)精制时,通常需在溶液中依次加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液并过滤,最后在滤液中加入盐酸至溶液呈中性。
①上述精制过程发生的反应均属于 。
②请写出对氯化钠饱和溶液进行电解,阳极发生反应的电极反应式: 。
(2)制金属镁。
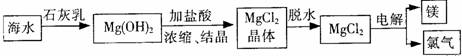
①从提高生产与经济效益的角度考虑,生产石灰乳的主要原料可选择当地海洋化学资源的一种物质,该物质是 。
A.石英砂 B.贝壳 C.食盐 D.苦卤水
②请简要说明上述制取金属镁的工艺流程省去“脱水”步骤造成的后果是 。
(3)制取溴单质。
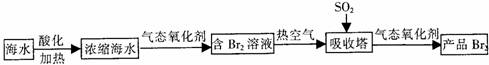
①吹入热空气的主要目的是 。
②吸收塔内发生的反应化学方程式为 。
③生产溴单质所用的气态氧化剂,可以从上述海水的综合利用中寻找货源,该气态氧化剂是 。
18.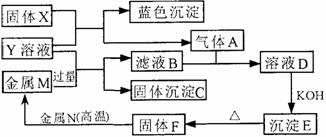 (10分)如下图,已知X为淡黄色固体,Y为中学化学中的一种常见的盐,可用于制农药;M、N均为常见的金属,N的氧化物是冶炼N的原料,也是较好的耐火材料;H为单质气体。下图中部分反应产物已略去。
(10分)如下图,已知X为淡黄色固体,Y为中学化学中的一种常见的盐,可用于制农药;M、N均为常见的金属,N的氧化物是冶炼N的原料,也是较好的耐火材料;H为单质气体。下图中部分反应产物已略去。
请回答下列问题:
(1)X的电子式为 。
(2)金属N的氧化物与NaOH溶液反应的离子方程式为 。
(3)滤液B通入气体A生成溶液D的离子方程式为 。
(4)固体F与金属N反应的化学方程式为 。
(5)若向100mL盐Y的溶液中加入10 g金属单质M的粉末,充分搅拌后,过滤,烘干得10.16g固体C。则滤液A中溶质的物质的量浓度为 。
17.(8分)几种短周期元素的原子半径及其某些化合价见下表:
|
元素代号 |
A |
B |
D |
E |
G |
H |
I |
J |
|
常见化合价 |
-1 |
-2 |
+4、-4 |
+6、+4、-2 |
+5、-3 |
+3 |
+2 |
+1 |
|
原子半径/pm |
64 |
66 |
77 |
104 |
110 |
143 |
160 |
186 |
试回答以下问题(涉及上述元素的答案,请用元素符号表示)。
(1)E元素在周期表中位于 。
(2)A、H、J对应离子的半径由大到小的顺序是 。
(3)DB2的结构式 。
(4)过量的D的最高价氧化物,与一定量的J的最高价氧化物对应水化物X的溶液发生反应的离子方程式: 。
16.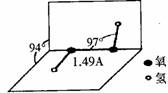 (10分)过氧化氢是一种无色透明的无毒液体,常被称为“绿色氧化剂”。
(10分)过氧化氢是一种无色透明的无毒液体,常被称为“绿色氧化剂”。
(1)过氧化氢的分子结构如右图,则下列有关过氧化氢的说法不正确的是 。
A.过氧化氢是非极性分子
B.过氧化氢分子中既有极性键,也有非极性键
C.过氧化氢分子中的氧原子以sp3杂化方式成键
D.常压下,过氧化氢的沸点高于水
(2)过氧化氢是一种弱酸,在298 K时,它的一级电离常数为K=1.55×10-12。请写出它在水中的主要电离方程式: 。
(3)过氧化氢可作为采矿业废液的消毒剂,如用来消除采矿废液中的氰化物,反应式(已配平)如下:KCN+H2O2+H2O= A +NH3↑。则被氧化的元素是 。
(4)过氧化氧作为绿色氧化剂,常与铜和稀硫酸共同制取硫酸铜。请写出反应的离子方程式: 。
(5)过氧化氢还可用作脱氯剂,其主要反应为C12+H2O2一O2+HCl,则每有0.2 mol H2O2参加反应转移的电子数为 。
15.(12分)根据侯德榜制碱法原理,某实验小组用食盐、氨水、大理石、盐酸制取碳酸钠。其实验过程如下:
①配制含氨的氯化钠饱和溶液; ②用石灰石和稀盐酸制取纯净的CO2;
③将CO2通入NaCl的氨溶液中,保持溶液的温度为40±2℃,得到碳酸氢钠晶体;
④冷却,减压过滤,用冷水洗涤沉淀; ⑤焙烧NaHCO3得到Na2CO3;
⑥向母液中加入粉状NaCl,并冷却至0℃以下,得到NH4Cl晶体。
已知:相关物质在不同温度下的溶解度数据(g/100g水)如下表:
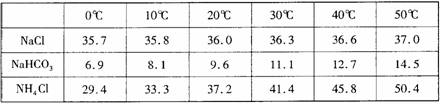
(1)侯德榜制碱法除了获得碳酸钠外,还能得到的副产品是 。
(2)过程中③中发生反应的化学方程式为 。
(3)为控制40±2℃的温度范围,采取的方法为 。
(4)判断过程④中沉淀已经洗涤干净的操作是 。
(5)加入粉状NaCl并冷却到0℃以下的目的是 。
(6)若实验时,所用饱和食盐水中含NaCl的质量为5.85 g,实验后得到干燥的NaHCO3晶体的质量为5.04 g,则NaHCO3的产率为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com