
2.非极性共价键:
(1)定义:(同种元素的原子)两种原子吸引电子能力相同,共用电子对不偏向任何一方,成键的原子不显电性,这样的共价键叫非极性键。简称非极性键。
(2)形成条件:相同的非金属元素原子间电子配对
(3)存在范围:非金属单质(稀有气体除外)及某些化合物中,如
H2、N2、O2、H2O2中的O-O键、Na2O2中的O-O键。
共价键根据成键的性质分为非极性共价键和极性共价键。
1.极性键:
不同种原子,对成键电子的吸引能力不同,共用电子对必然偏向吸引电子能力强(即电负性大)的原子一方,使该原子带部分负电荷(δ-),而另一原子带部分正电荷(δ+)。这样,两个原子在成键后电荷分布不均匀,形成有极性的共价键。
(1)不同种元素的原子形成的共价键叫极性共价键,简称极性键。
(2)形成条件:不同非金属元素原子间配对(也有部分金属和非金属之间形成极性键)。
(3)存在范围:气态氢化物、非金属氧化物、酸根、氢氧要、有机化合物。
在共价化合物中,原子之间是通过共用电子对形成的共价键的作用结合在一起的,所以本身没有阴阳离子,因此不会出现阴阳离子和中括号
 如:
如: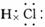
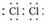
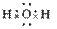
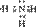
共价化合物的形成过程:
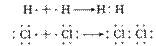
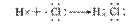
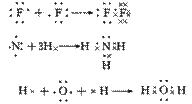
6.存在范围:
①非金属单质的分子中(除稀有气体外):如O2/F2/H2/C60
②非金属形成的化合物中,如SO2/CO2/CH4/H2O2/CS2
 ③部分离子化合物中,如Na2SO4中的SO42-中存在共价键,NaOH的OH-中存在共价键,NH4Cl中的NH4+存在共价键
③部分离子化合物中,如Na2SO4中的SO42-中存在共价键,NaOH的OH-中存在共价键,NH4Cl中的NH4+存在共价键
5.成键原因:①通过共用电子对,各原子最外层电子数目一般能达饱和,由不稳定变稳定;②两原子核都吸引共用电子对,使之处于平衡状态;③原子通过共用电子对形成共价键后,体系总能量降低。
4.成键条件:同种非金属原子或不同种非金属原子之间,且成键的原子最外层电子未达到饱和状态
3.成键性质:共用电子对两原子的电性作用
2.成键粒子:原子
1.概念:原子之间通过共用电子所形成的相互作用。
3.离子化合物的形成过程:
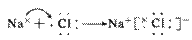
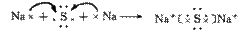
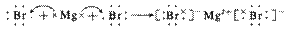
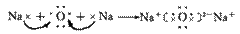
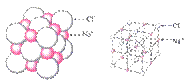 注:①不是所有的离子化合物在形成过程中都有电子的得失,如NH4+与Cl-结合成NH4Cl的过程。
注:①不是所有的离子化合物在形成过程中都有电子的得失,如NH4+与Cl-结合成NH4Cl的过程。
②对于离子化合物化学式不等于分子式,在离子化合物中不存在分子,如NaCl的晶体结构为:
在这个结构中Na+和Cl-的个数比为1:1,所以氯化钠的化学式为NaCl。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com