
14.答案:A
解析:n(浓H2SO4)=0.05×18=0.9 mol。由反应Cu+2H2SO4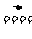 CuSO4+SO2↑+2H2O,看出有2 mol H2SO4参加反应,被还原的H2SO4为参加反应的一半,由此有0.9 mol 浓H2SO4反应时就有0.45 mol H2SO4被还原。但实际上由于H2SO4随反应进行浓度变稀,而变为稀H2SO4后,则不能与Cu反应。所以实际被还原的H2SO4应小于0.45 mol。故选A。
CuSO4+SO2↑+2H2O,看出有2 mol H2SO4参加反应,被还原的H2SO4为参加反应的一半,由此有0.9 mol 浓H2SO4反应时就有0.45 mol H2SO4被还原。但实际上由于H2SO4随反应进行浓度变稀,而变为稀H2SO4后,则不能与Cu反应。所以实际被还原的H2SO4应小于0.45 mol。故选A。
13.答案:C
12.答案:B
解析:H2S在足量O2中燃烧,方程式为2H2S+3O2===2SO2+2H2O。O2不足时:2H2S+O2===2S+2H2O。SO2与Ca(OH)2反应时首先发生:SO2+Ca(OH)2===CaSO3↓+H2O,当SO2过量时又发生反应:CaSO3+SO2+H2O===Ca(HSO3)2。稀H2SO4与Zn反应放出H2,浓H2SO4与Zn反应放出SO2。
11.答案:C
解析:n(S)= 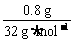 =0.025
mol,该单质与硫的物质的量之比是2∶1,所以该单质在四个选项中只能是钾。
=0.025
mol,该单质与硫的物质的量之比是2∶1,所以该单质在四个选项中只能是钾。
10.答案:C
解析:锌与稀HNO3反应,被还原的是氮元素,产生的是氮的氧化物而不是H2。因氯化氢易溶于水,制备时用固体食盐与浓H2SO4反应。浓H2SO4中H+浓度小与CaCO3反应慢,且CaSO4微溶于水,反应难于进行。
9.答案:C
解析:此题考查了工业生产H2SO4的重要设备之一--接触室中气体的流向。SO2和O2进入热交换器的管外时,虽具备合成温度,但无V2O5催化,不会生成SO3,只有SO2和O2。
8.答案:AD
解析:此题全面考查了硫的存在和性质。硫是一种淡黄色不溶于水的晶体,直接与氧气反应的产物是SO2,SO2被氧气氧化为SO3必须是在催化剂的条件下进行。
7.答案:B
解析:浓硫酸可干燥酸性气体和一些中性气体,但不能干燥具有还原性的气体,如H2S、HI等。SO2尽管有较强的还原性,但不能被浓硫酸氧化。
6.答案:A
解析:环境污染与保护是当今社会普遍关注的问题,这类题目在今后的高考中也会出现,且比重会增加。引发酸雨的主要是氮和硫的氧化物,光化学烟雾主要与NO2和NO有关;氟利昂是破坏臭氧层的最主要物质;大气中CO2含量的增加引起了温室效应。
5.答案:C
解析:此题考查了学生思维能力的严密性。只要仔细分析四个选项,不必计算就可找出答案,SO2与H2S不能共存,故A不可能;若只剩余O2,说明O2过量,则必有SO2生成,故B也不可能;H2S在过量O2中燃烧只能生成SO2,SO2要转化为SO3必须有催化剂的参与,故D项不可能;所以答案应为C。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com