
26.已知SO32-+I2+H2O=SO42-+2I-+2H+。某溶液中可能含有I-、NH4+、Cu2+、SO32-,向该无色溶液中加入少量溴水,溶液仍呈无色。则下列关于该溶液组成的判断正确的是( )
A.肯定不含I- B.肯定不含Cu2+ C.可能含有SO32- D.肯定不含有NH4+
25、a、b、c、d、e分别为MgCl2、KHSO4、KOH、NaHCO3、AlCl3五种溶液中的一种,其中a能与其余四种溶液反应,且b、d反应时无明显现象;b与d反应只产生气泡;e只能与a反应。下列推理不正确的是( )
A.a一定为KOH溶液 B.b一定为KHSO4溶液
C.c一定为AlCl3溶液 D.e一定为MgCl2溶液
24、在一定条件下化学反应:2SO2(g)+O2(g) 2SO3(g);△H=-197kJ/mol。现有容积相同且不变的甲.乙.丙三个容器,在上述条件下分别充入的气体和达到平衡时反应放出的热量(Q)如下表所列:
2SO3(g);△H=-197kJ/mol。现有容积相同且不变的甲.乙.丙三个容器,在上述条件下分别充入的气体和达到平衡时反应放出的热量(Q)如下表所列:
|
容 器 |
SO2(mol) |
O2(mol) |
N2(mol) |
Q(kJ) |
|
甲 |
2 |
1 |
0 |
Q1 |
|
乙 |
1 |
0.5 |
0 |
Q2 |
|
丙 |
1 |
0.5 |
1 |
Q3 |
根据以上数据,下列叙述不正确的是 ( )
A. 2SO2(g)+O2(g) 2SO3(s);△H=-QkJ/mol Q<197kJ
2SO3(s);△H=-QkJ/mol Q<197kJ
B.在上述条件下每消耗2摩SO2气体时放出的热量为197 kJ
C.在上述条件下反应生成1 molSO3气体放热98.5 kJ
D.2Q2=2Q3<Q1<197 kJ
23、能正确表示下列反应的离子方程式是
A.氨水中通入过量CO2:2NH3·H2O + CO2 = 2NH4+ + CO32- + H2O
B.氯化亚铁溶液中加入硝酸:Fe2+ + 4H+ + NO3- = Fe3+ + 2H2O + NO↑
C.将标准状况下112 mL氯气通入10 mL 1 mol·L-1的溴化亚铁溶液中:
2Fe2+ + 4Br-+ 3Cl2 = 2Fe3+ + 6Cl- + 2Br2
 D.用小苏打治疗胃酸过多:HCO-3+H+ = CO2↑+H2O
D.用小苏打治疗胃酸过多:HCO-3+H+ = CO2↑+H2O
22、常温下,下列溶液可能大量共存的离子组是
A.含有大量S2-的溶液:Na+、C1O-、C1-、CO32-
B.含有大量Fe3+的溶液:K+、Na+、A1O2-、SO42-
C.能使pH试纸变红的溶液:NH4+、Na+、NO3-、HCO3-
D.水电离产生的c(H+)=1×10-12mol·L-1的溶液:Mg2+、SO42-、NO3-、C1-
21、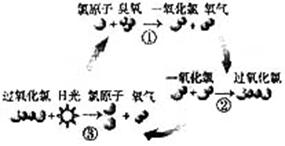 1995年三位美国科学家因在氟利昂和臭氧层方面的工作获得诺贝尔化学奖,他们的研究揭示了大气中臭氧层被破坏的机理,由图可知(
)
1995年三位美国科学家因在氟利昂和臭氧层方面的工作获得诺贝尔化学奖,他们的研究揭示了大气中臭氧层被破坏的机理,由图可知(
)
A.日光在反应中做催化剂
B.过氧化氯是一种很稳定的物质
C.过氧化氯的结构式为O-Cl-Cl-O
D.臭氧分子最终转变为氧气分子
20、灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s、灰)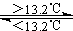 Sn(s、白)
△H3=+2.1kJ/mol
Sn(s、白)
△H3=+2.1kJ/mol
下列说法正确的是
A.△H1>△H2
B.锡在常温下以灰锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
19、下表为4种常见溶液中溶质的质量分数和物质的量浓度:
|
溶 质 |
HCl |
NaOH |
CH3COOH |
HNO3 |
|
溶质的质量分数/% |
36.5 |
40 |
60 |
63 |
|
物质的量浓度/mol·L-1 |
11.8 |
14.3 |
10.6 |
13.8 |
这4种溶液中密度最小的是( )
A.HCl B.NaOH C.CH3COOH D.HNO3
18、 参照反应Br+H2
参照反应Br+H2
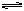 HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )
HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )
A. 该反应的△H=+(E1-E2)kJ/mol
B. 加入催化剂,该化学反应的反应热变大
C. 反应物总能量高于生成物总能量
D. 升高温度可增大正反应速率,降低逆反应速率
17、氯酸质量分数超过40%时会发生分解,反应可表示为:8 HClO3 = 3 O2↑+ 2 Cl2↑+ 4 HClO4 + 2 H2O,下列说法正确的是
A.氧化性比较HClO4 > HClO3 B.氧化产物只有HClO4
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com