
2. 单线桥--表示电子转移情况

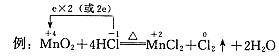
要点:(1)单箭号(在反应物之间);
(2)箭号起点为被氧化(失电子)元素,终点为被还原(得电子)元素;
(3)只标转移电子总数,不标得与失(氧化剂得电子总数等于还原剂失电子总数)。
例5.判断下列反应哪些是氧化还原反应,哪些是非氧化还原反应?是氧化还原反应的用单线桥(或双线桥)表示电子转移的方向和数目,并指出氧化剂和被氧化的物质。
(1)Cl2+2KI=2KCl+I2
(2)Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
(3)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
解析: (1)中氯元素化合价由0下降到-1,被还原,Cl2是氧化剂;碘元素化合价由-1升高到0,被氧化,KI是被氧化的物质。(3)氮元素化合价由+5下降到+2,被还原,硝酸是氧化剂;铜元素化合价由0升高到+2,被氧化,铜是被氧化的物质;(2)中无元素化合价变化,是非氧化还原反应
答案:(1)(3)是氧化还原反应,(2)是非氧化还原反应。
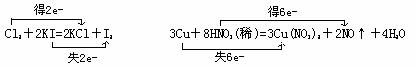
(1)中Cl2是氧化剂,KI是被氧化的物质;(3)中硝酸是氧化剂,铜是被氧化的物质。
[强化训练]
1. 双线桥--表示电子得失的结果
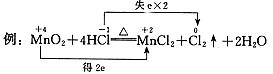
 要点:(1)双箭号(从反应物指向生成物);
要点:(1)双箭号(从反应物指向生成物);
(2)箭号起、止所指为同一种元素;
(3)标出得与失电子及总数(氧化剂得电子总数等于还原剂失电子总数)。
2. 化合反应、分解反应、置换反应与氧化还原反应的交叉分类示意图
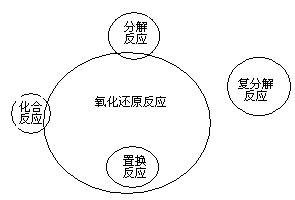
置换反应一定是氧化还原反应,化合反应、分解反应可能是氧化还原反应,复分解反应都不是氧化还原反应。
1、 把化学反应分成氧化还原反应、非氧化还原反应和四种基本类型反应,是两种不同的分类方法。前者分类根据化学反应实质,后者分类根据反应物、生成物种类的多少和类别,所以从分类的根据上看,前者较后者更深入本质。
把化学反应分成氧化还原反应、非氧化还原反应和四种基本类型反应,是两种不同的分类方法。前者分类根据化学反应实质,后者分类根据反应物、生成物种类的多少和类别,所以从分类的根据上看,前者较后者更深入本质。
化学反应的不同分类方法的关系是:
|
基本类型 |
氧化还原反应 |
非氧化还原反应 |
|
化合 |
2Cu+O2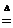 2CuO 2CuO |
CaO+H2O=Ca(OH)2 没有单质参加反应 |
|
分解 |
2KClO3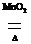 2KCl+3O2↑ 2KCl+3O2↑ |
NH4HCO3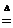 NH3↑+H2O+CO2↑ 没有单质生成 NH3↑+H2O+CO2↑ 没有单质生成 |
|
置换 |
Fe+2HCl=FeCl2+H2↑ |
|
|
复分解 |
|
H2SO4+Ba(OH)2=BaSO4↓+2H2O |
2、常见还原剂:在化学反应是易失电子被氧化的物质。
(1)典型的金属单质如:K、Ca、Na、Mg…(其还原性强弱与金属活动性基本一致)。
(2)某些非金属单质及氧化物如:H2、C、CO、SO2…。
(3)有变价元素的低价态化合物如:H2S、HI、HBr、HCI、FeSO4 、Na2SO3…。
(4)非金属阴离子如:S2-、I-、Br-、CI-…。
例3:某元素在化学反应中,由化合态变为游离态,则该元素( )
A. 一定被氧化 B. 一定被还原
C. 可能被氧化,也可能被还原 D. 化合价降低为0
解析:化合态时元素的化合价可能是正价,也可能是负价,转变成游离态0价,因此,元素可能是被还原也可能是被氧化,所以选C。
小结:金属元素只能失电子,只有正价,所以金属单质只有还原性;非金属元素既能得电子表现负价,又能失(偏离)电子表现正价,所以非金属单质多数既有氧化性又有还原性。
例4:从氧化、还原的观点分析氯气和盐酸的化学性质。
解析:氯气的化学性质,如氯气跟金属单质(钠、铁、铜……)、非金属单质(氢气、磷……)的反应中都是得电子,化合价降低被还原,作氧化剂,因此氯气具有强氧化性;但氯气也有还原性,如氯气跟水、碱溶液所发生反应,其中有一部分氯就是表现了还原性。
 盐酸也是既有氧化性又有还原性的。如在盐酸跟镁、铝、锌等较活泼金属发生的置换反应中,盐酸表现了氧化性。在浓盐酸跟二氧化锰反应制取氯气时,盐酸表现了还原性。由于盐酸的氧化性实质上是H+的氧化性,属于酸的通性,即绝大多数酸所具有的共同性质,因此不能把盐酸称为氧化性酸。
盐酸也是既有氧化性又有还原性的。如在盐酸跟镁、铝、锌等较活泼金属发生的置换反应中,盐酸表现了氧化性。在浓盐酸跟二氧化锰反应制取氯气时,盐酸表现了还原性。由于盐酸的氧化性实质上是H+的氧化性,属于酸的通性,即绝大多数酸所具有的共同性质,因此不能把盐酸称为氧化性酸。
1、常见的氧化剂:在化学反应中易得电子被还原的物质。
(1)典型的非金属单质如:O2、Cl2、Br2、I2、S…(其氧化性强弱与非金属活动性基本一致)。
(2)有变价元素的高价态化合物如: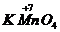 、
、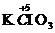 、浓
、浓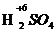 、
、 、
、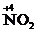 …。
…。
(3)金属阳离子如:Fe3+、Cu2+、(H+)…(在金属与酸、盐溶液的置换反应,如反应Fe+CuSO4=FeSO4+Cu中,实质上是Cu2+离子氧化Fe原子,Cu2+作氧化剂,Fe是还原剂)。
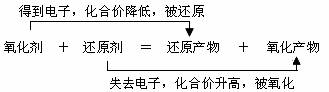
3. 氧化剂、还原剂、氧化反应、还原反应、氧化产物、还原产物的判断:
氧化剂: 得到电子(所含元素化合价降低)的反应物
还原剂: 失去电子(所含元素化合价升高)的反应物
(1) 氧化剂和还原剂均是指反应物质,是一种化学试剂,而不是某一种元素。
(2) 氧化剂具有氧化性,氧化剂本身被还原,即发生还原反应,转化为还原产物;还原剂具有还原性,还原剂本身被氧化,即发生氧化反应,转化为氧化产物。

例1:在下列各式中,当左边的物质能生成右边的物质时,试指出下列带点的元素是被氧化还是被还原?
(1)KClO3→KCl (2)HClO→O2 (3)KI→I2 (4)NO2→HNO3
解析:(1)中氯元素化合价由+5下降到-1,被还原;(2)中氧元素化合价由-2升高到0,被氧化;(3)中碘元素化合价由-1升高到0,被氧化;(4)中氮元素化合价由+4升高到+5,被氧化。
答案:(1)中氯元素被还原;(2)中氧元素被氧化;(3)中碘元素被氧化;
(4)中氮元素被氧化。
例2:二氧化硫与硫化氢相遇,发生如下反应:SO2+2H2S=2H2O+3S↓
在这个反应中二氧化硫和硫化氢,哪个是氧化剂,哪个是还原剂?在反应的产物中,氧化产物与还原产物的物质的量之比是多少?

 解析:二氧化硫中硫元素的化合价由+4下降到0,二氧化硫被还原,做氧化剂;硫化氢中硫元素化合价由-2升高到0,硫化氢被氧化,做还原剂。每生成3molS中,有2molS是硫化氢中-2价的硫被氧化而来的,属氧化产物,有1molS是二氧化硫中的+4价的硫被还原来的,属还原产物,所以氧化产物与还原产物的物质的量之比是2:1。
解析:二氧化硫中硫元素的化合价由+4下降到0,二氧化硫被还原,做氧化剂;硫化氢中硫元素化合价由-2升高到0,硫化氢被氧化,做还原剂。每生成3molS中,有2molS是硫化氢中-2价的硫被氧化而来的,属氧化产物,有1molS是二氧化硫中的+4价的硫被还原来的,属还原产物,所以氧化产物与还原产物的物质的量之比是2:1。
答案:二氧化硫是氧化剂,硫化氢是还原剂;氧化产物与还原产物的物质的量之比是2:1。
2. 氧化还原反应的特征(判断依据):反应前后元素化合价发生了变化。
1. 氧化还原反应的本质:电子的转移(电子的得失或电子对的偏移)
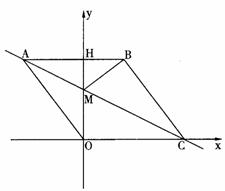
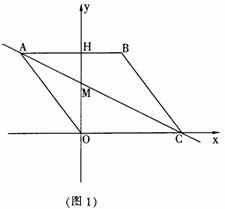
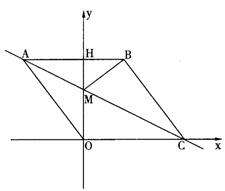
28.(本题10分)
如图1,在平面直角坐标系中,点O是坐标原点,四边形ABCO是菱形,点A的坐标为(-3,4),
点C在x轴的正半轴上,直线AC交y轴于点M,AB边交y轴于点H.
(1)求直线AC的解析式;
(2)连接BM,如图2,动点P从点A出发,沿折线ABC方向以2个单位/秒的速度向终点C匀速运动,设△PMB的面积为S(S≠0),点P的运动时间为t秒,求S与t之间的函数关系式(要求写出自变量t的取值范围);
(3)在(2)的条件下,当 t为何值时,∠MPB与∠BCO互为余角,并求此时直线OP与直线AC所夹锐角的正切值.









提供者:罗天仁
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com