
20、某实验人员做了下列实验:将一定量1.00mol/L CuSO4溶液和2.00mol/LNaOH溶液混合,得到一种浅绿色沉淀X。将
(1)该实验人员认为沉淀X可能含有SO42-。请设计一个简单实验确定这一判断。
(2)Y与稀硫酸反应的离子方程式为: 。
(3)通过计算确定X的组成?
(4)混合时CuSO4和NaOH溶液的体积比为 ;写出X→Y的反应方程式::
。
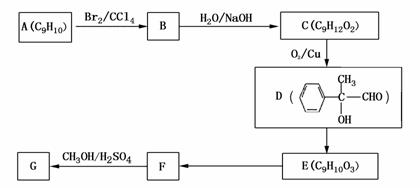 ?
?
① 化合物E中的官能团有 (填名称)。
② F→G的反应类型是 ,该反应的化学方程式为 。
③ 写出符合下列条件的F的同分异构体的结构简式 。
?.分子内含苯环,且苯环上只有一个支链;?
?.一定条件下,1mol该物质与足量银氨溶液充分反应,生成4mol银单质。
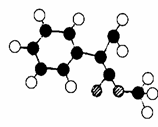 (3)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如
(3)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如
右图所示(图中球与球之间连线表示单键或双键)。G的
结构简式为 ;
(4)用芳香烃A为原料合成G的路线如下:?
19、肉桂酸甲酯(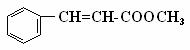 )常用于调制具有草莓、葡
)常用于调制具有草莓、葡
萄、樱桃、香子兰等香味的食用香精。
(1)肉桂酸甲酯的分子式是 ;
(2)有关肉桂酸甲酯的叙述中,正确的是 (填标号);
A.能与溴的四氯化碳溶液发生加成反应 B.无法使酸性高锰酸钾溶液褪色
C.在碱性条件下能发生水解反应 D.不可能发生加聚反应
C(s)
+ H2O(g)  H2(g) + CO(g) △H = +131.3 kJ/mol
H2(g) + CO(g) △H = +131.3 kJ/mol
该反应在低温下不能自发进行的原因是 。
A.△H >0 B.温度较低时,△H影响为主
C.△S<0 D.温度较低时,△S影响为主
 |
(4)工业上生产氢气是将水蒸气通过红热的炭,产生水煤气:
(3)氢气是合成氨的重要原料。工业上合成氨的反应是:N2(g)
+ 3H2(g) 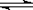 2NH3(g);ΔH= -92.2 kJ?mol-1。
2NH3(g);ΔH= -92.2 kJ?mol-1。
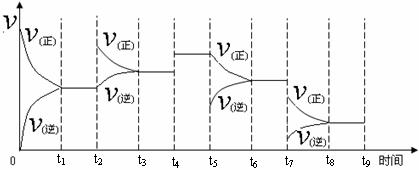
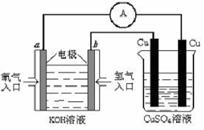
①一定条件下,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中加入催化剂引起反应速率变化的时间段是 (填,如0~t1等)。
 |
(1) 氢气燃烧热值高。实验测得,在常温常压下,1gH2完全燃烧生成液态水,放出142.9 kJ 热量。则H2燃烧的热化学方程式为 。
18、氢气是一种新型的绿色能源,又是一种重要的化工原料。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com