
科目: 来源: 题型:计算题
向20g赤铁矿样品中(样品中杂质不溶于水,也不和酸反应)不断加入稀盐酸至固体量不再减少为止,共消耗稀盐酸184g,测得剩余固体的质量为4g。请计算:
(1)赤铁矿样品中,氧化铁的质量分数
(2)最后所得溶液中溶质的质量分数
查看答案和解析>>
科目: 来源: 题型:填空题
金属是一种非常重要的资源,在生产、生活中有着广泛的用途.
(1)人类每年从自然界提取大量的金属,其中提取量最大的是铁.用赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的化学方程式为 .
(2)每年世界上钢铁的产量很高,可全世界每年因生锈损失的钢铁约占世界钢铁年产量的1/4,这给人类带来了巨大的损失.铁在空气中锈蚀,实际上是铁跟空气中的 共同作用的结果.现有一批铁质螺丝钉已经开始生锈,你能用化学方法除锈,并做防锈处理吗?请简要写出你的做法及涉及到的化学方程式. 。
(3)亮亮同学用稀盐酸和另一种溶液,验证了Mg、Fe、Cu、Ag四种金属的活动性顺序是依次减弱的.请回答下列问题:
①亮亮所用的另一种溶液是 .
②说明Mg比Fe活泼的实验现象是 .
③说明Cu比Ag活泼的实验现象是 .
(4)我国在金属冶炼方面有着悠久的历史,早在南北朝时期就开始冶铸黄铜.黄铜是由铜和锌组成的,它可以用来制造机器、电器零件及日用品.现为测定某黄铜样品中铜的含量,取该黄铜样品10g,放入100g的稀盐酸中,恰好完全反应.此时烧杯内各物质的总质量为109.8g.试计算:
(1)该黄铜样品中铜的质量分数;
(2)反应所用稀盐酸的溶质质量分数.
查看答案和解析>>
科目: 来源: 题型:填空题
铁矿石冶炼成铁是一个复杂的过程。炼铁的原理是利用一氧化碳与氧化铁的反应,该化学方程式为 。
(1)某钢铁厂每天需消耗5000t含氧化铁76%的赤铁矿石,该厂理论上可以日产含铁98%的生铁的质量是多少?
(请写出计算过程,结果精确到0.1t)
(2)某化学兴趣小组在实验室中模拟炼铁原理的实验,并对固体产物的成分进行探究。
【设计实验】用一氧化碳还原纯净的氧化铁粉末,实验装置如图,酒精灯b的作用是 。
【进行实验】该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)。
②反应后玻璃管和内盛黑色固体的总质量m(冷却到室温称量)。
【分析与讨论】本实验中,玻璃管内固体粉末由红色全部变为黑色。小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料。
【查阅资料】
①一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关。
②一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁、铁。
③
| 物质 性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
查看答案和解析>>
科目: 来源: 题型:填空题
钙是维持人体正常功能所必需的元素。钙尔奇是常用的补钙剂,主要成分是CaCO3,钙尔奇每片2.0g。取1片钙尔奇,放入盛有10g稀盐酸的烧杯中,其中碳酸钙跟盐酸恰好完全反应(其它成分与盐酸不反应)。烧杯内物质质量变为11.34g。试计算:
(1)反应产生二氧化碳 g,是 mol;
(2)每片钙尔奇中含碳酸钙 mol;
(3)服用钙尔奇通常一日2次,每次1片。则每人每天摄入钙元素的质量为 g。
(4)根据化学方程式列式计算上述反应所用稀盐酸溶质的质量分数(精确到0.01%)
查看答案和解析>>
科目: 来源: 题型:填空题
农技人员采用“测土配方”技术对一片果园进行了土壤检测,结果显示该果园需要补充一定量的氮元素和钾元素。
(1)氮是植物生长的重要元素,果园土壤中缺少氮元素,需要用氮肥来补充,下列属于氮肥的是 (填序号)。
①KCl; ②NH4HCO3; ③Ca3(PO4)2。
(2)“测土配方”可以实现“缺什么、补什么”,使用该技术的好处是 。
(3)某同学取丰收牌钾肥(如图1)样品2.0g,溶于足量的水中,滴加过量氯化钡溶液,产生沉淀质量与所加氯化钡溶液质量的关系如图2。试通过计算判断该钾肥中硫酸钾的质量分数是否符合产品外包装说明?(反应方程式为:K2SO4+BaCl2=BaSO4↓+2KCl,杂质不参加反应。)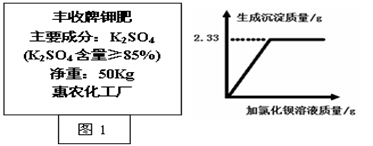
查看答案和解析>>
科目: 来源: 题型:填空题
小强去商店买回一包纯碱,包装说明如右图.为测定该纯碱中碳酸钠含量是否符合标签要求,他称取了纯碱样品11g,全部溶解在50g水中,当加入稀盐酸64.4g时,恰好完全反应,所得溶液的质量为121g.试求:
(1)反应放出的CO2的质量为 g。
(2)纯碱样品中碳酸钠的质量。
(3)根据这一次检测,计算并判断样品中碳酸钠的含量是否符合标签要求。
查看答案和解析>>
科目: 来源: 题型:填空题
阿斯匹林的主要成分是乙酰水杨酸(化学式为C3H2O4),具有抑制血小板发挥作用的功能,是治疗心血管疾病的重要药物之一.
(1)乙酰水杨酸中氢、氧两种元素的质量比为
(2)乙酰水杨酸具有酸性,若在其无色溶液中滴入紫色石蕊试液,观察到溶液呈 色.
(3)人体内的血小板有何作用? 。
查看答案和解析>>
科目: 来源: 题型:填空题
化学在防治大气污染和水污染等方面发挥了重要作用,使更多地化学生产工艺和产品向着环境友好的方向发展.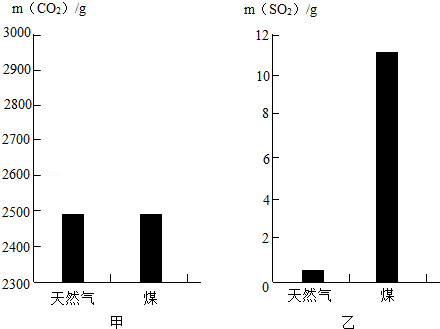
(1)为从源头消除污染,生产、生活中要选择对环境影响小的燃料,已知充分燃烧1kg天然气和煤所产生的CO2和SO2气体的质量如图所示,则 燃烧产生的气体更易导致酸雨.
(2)某火力发电厂为了防止环境污染,需将废气中的二氧化硫进行处理,其发生的主要反应为2CaCO3+2SO2+O2=2CaSO4+2CO2,若100g废气中含有1.6g二氧化硫,则处理1000g这种废气需含碳酸钙80%的石灰石 g.
(3)某工厂以流量10L/s(升/秒)排出含硫酸9.8%的工业废水,现向该废水中排入含氢氧化钠2%的工业废水,与硫酸反应后再排出,要使处理后的废水呈中性,则含氢氧化钠2%的工业废水的流量应为 L/s(上述含酸废水和含碱废水的密度均近似为1g/cm3).
查看答案和解析>>
科目: 来源: 题型:填空题
过氧乙酸是一种消毒剂.在2003年抗击“非典”的过程中发挥了巨大的作用.某医疗小组分队用溶质质量分数为0.5%的过氧乙酸溶液对环境进行消毒.
(1)过氧乙酸的化学式为C2H4O3.过氧乙酸中碳、氢、氧元素的质量比为 (填最简单整数比).
(2)要配制溶质质量分数为0.5%的过氧乙酸溶液600kg.需要溶质质量分数为15%的过氧乙酸溶液 kg.
(3)配制的主要步骤是计算、量取、
查看答案和解析>>
科目: 来源: 题型:填空题
(5分)煤、石油、天然气是化石燃料。
(1)石油属于 (填“纯净物”或“混合物”)
(2)天然气(主要成分CH4)完全燃烧的方程式是 ;
(3) 煤是复杂的混合物,主要含有碳元素,还含有硫等元素,100t含硫4%的煤完全燃烧,会向空气中排放 t二氧化硫。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com