
科目: 来源:不详 题型:实验题

查看答案和解析>>
科目: 来源:不详 题型:实验题

查看答案和解析>>
科目: 来源:不详 题型:实验题

查看答案和解析>>
科目: 来源:不详 题型:实验题
| 实验操作 | 实验现象 | 实验结论 |
| Ⅰ取少量黑色产物加入到装有足量FeCl3溶液的烧杯中,充分反应后过滤,对过滤所得固体用蒸馏水洗涤。 | 黑色固体部分溶解。 | 猜想2和4都 不成立。 |
| Ⅱ , 。 | 黑色固体全部溶解,溶液 不变红色。 | |
| Ⅲ另取少量黑色产物装入玻璃管中,通入C0,一段时间后加热,并将反应后的气体通入装有一定量的 的烧杯中。 | 。 | 猜想l不成立, 猜想3成立。 |
查看答案和解析>>
科目: 来源:不详 题型:实验题
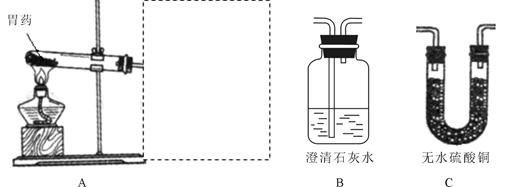
| 实验过程 | 实验现象 | 实验结论 |
| 乙同学选用B、C装置,按A→B→C顺序连接,点燃酒精灯加热 | B中 , C中 。 | 该胃药中含有MgCO3、Al(OH)3 |
| 丙同学也选用B、C装置,按A→C→B顺序连接,点燃酒精灯加热 | C中无明显现象,B中澄清石灰水变浑浊。 | 该胃药中不含有 |
查看答案和解析>>
科目: 来源:不详 题型:实验题

查看答案和解析>>
科目: 来源:不详 题型:实验题
查看答案和解析>>
科目: 来源:不详 题型:实验题



查看答案和解析>>
科目: 来源:不详 题型:实验题

查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.用Al(OH)3治疗胃酸过多症:Al(OH)3+3HCl==AlCl3+3H2O |
| B.实验室用稀硫酸与铜片反应制取H2:Cu+H2SO4==CuSO4+H2↑ |
| C.用铁粉从含硝酸银的废水中提取金属银:Fe+3AgNO3==Fe(NO3)3+3Ag |
| D.用点燃的方法除去二氧化碳气体中混有的少量一氧化碳:2CO+O2点燃 2CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com