
科目: 来源: 题型:
【题目】鸡蛋主要由蛋壳、蛋壳膜、蛋白、蛋黄等几个部分组成,其中蛋壳的主要成分是CaCO3,里面覆盖一层蛋壳膜。化学活动兴趣小组的同学开展了以下探究活动:
【提出问题】蛋壳中的CaCO3含量是多少?

【查阅资料】
a、蛋壳经过科学检测其中含CaCO3的质量分数约为82%~85%,含蛋白质质量分数约14-17%。
b、蛋壳膜中蛋白质含量约为90%~93%。
c、Ba(OH)2是一种碱,化学性质与Ca(OH)2相似。
【设计方案】
方案一:用“灼烧法”,将该蛋壳放在空气中充分灼烧并采集相关数据进行测定。
方案二:用“酸处理法”,将蛋壳与稀盐酸反应后再进行吸收转变为碳酸钡进行测量处理。
【进行实验】
方案一:称取12.0 g蛋壳研磨成粉末置于通风橱中,灼烧至质量不再减少,再称量剩余固体的质量为7.16 g。
方案二:用下图所示的连接实验装置,称取12 g蛋壳样品进行实验(假设其他成分均不与HCl反应,装置内试剂均足量。)

【实验步骤】
① 按上图连接好装置后,并检查装置的气密性;
② 向B装置中加入蛋壳样品后,先通入一会儿空气;
③ 关闭K1,打开K2,向蛋壳样品中滴入10%的盐酸,直到__________为止;
④ 关闭K2,打开K1,再缓缓通入空气一会儿,至装置C中不再产生沉淀为止;
⑤ 将装置C中的固液混合物进行过滤、__________、烘干后称量其质量;
⑥ 重复上述实验。
【数据处理】
方案一:产生的CO2质量__________g,蛋壳中的CaCO3的质量分数为__________%。(保留一位小数)
方案二:重复3次实验,记录数据如下:
实验次数 | 第1次 | 第2次 | 第3次 |
装置C中沉淀质量(/g) | 19.68 | 19.75 | 19.67 |
方案二:实验测得蛋壳中的CaCO3的质量分数__________(写出计算过程,)
(已知:Mr(CaCO3):100 Mr(BaCO3):197)
【评价反思】
(1)方案二中装置D的作用是__________。
(2)方案一测定值与科学检测的数据有较大误差,主要原因是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫铁矿烧渣(主要成份Fe2O3、Fe3O4、FeO、SiO2等,铁的氧化物均能与盐酸反应,SiO2不与酸反应)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红(Fe2O3)等产品的部分流程如图所示:

(1)焙烧时C与O2不完全燃烧产生的气体都能将铁的多种氧化物还原成铁。试写出该气体与Fe3O4反应的化学方程式__________。
(2)酸浸、过滤后滤液中的溶质主要是__________。(填化学式)
(3)在空气中煅烧FeCO3即FeCO3与空气中的O2反应生成Fe2O3和CO2,试写出该反应的化学反应方程式为:__________。
(4)若产品a的主要成分是K2SO4,得到产品a时加入的试剂X为__________。由此判断在此条件下K2SO4的溶解度__________NH4Cl的溶解度(选填“<”或“>”或“=”)。
(5)可选用下列__________(填字母)洗涤产品a。
A.KCl饱和溶液 B.水 C.饱和K2SO4溶液.
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室有盐酸、白醋和柠檬酸三种溶液,回答下列问题:
(1)向氧化铁中放入足量盐酸,振荡,充分反应后,观察到的现象是_________________,反应的化学方程式是________________________________________。
(2)白醋、柠檬酸溶液也能与氧化铁发生类似反应,说明白醋、柠檬酸溶液和盐酸中都含有的离子是__________。
(3)理论上溶解3.2g氧化铁,需要36.5%盐酸__________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】请结合下图回答问题:

(1)写出图中有标号仪器的名称:①__________,② __________。
(2)用加热高锰酸钾的方法制取氧气,应选用的发生装置是(填字母编号)__________,装入药品前应先__________,写出该反应化学方程式__________。
(3)用B、D装置组合制取二氧化碳气体的化学方程式__________。 若要获得干燥的该气体,除发生、收集装置外,还应选用G装置,并在该装置中盛放__________(填名称)。如果用H装置收集该气体,则气体从__________端进入(填“a”或“b”)。
(4)实验室用锌粒和稀硫酸反应制取H2的化学方程式__________,常选用装置B或C, C与B相比较,C的优点是__________。
(5)实验室使用的稀硫酸通常都是将浓硫酸用水稀释而成的。现欲用98%的硫酸(密度为1.84g/mL)配置19.6%的稀硫酸100 g,需要浓硫酸的体积为__________mL(保留到小数点后一位),量取水时应选用规格(从10mL、50mL、100mL中选取)为__________mL的量筒。稀释浓硫酸的操作为:__________,并用玻璃棒不断搅拌。最后将稀硫酸转移到试剂瓶中,贴上标签备用,在标签上可以不必注明的是__________(填字母序号)。
A.100 g B.19.6% C.稀硫酸
查看答案和解析>>
科目: 来源: 题型:
【题目】碲(Te)被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”。实验室模拟提取碲的一个实验是:取某含碲溶液于烧瓶中,加入适量NaCl,加热到一定温度,持续通入SO2,待反应一定时间,过滤得到粗碲。
(1)反应的总化学方程式为: ![]() ,则X为__________(填化学式)。
,则X为__________(填化学式)。
(2)为探究获得较高粗碲沉淀率的反应条件,某研究小组在控制NaCl浓度和SO2流量不变的条件下,进行下述对比试验,数据如下:
实验 | 温度/℃ | 反应时间/h | 粗碲沉淀率 |
a | 65 | 3.0 | 65.0 |
b | 80 | 3.0 | 98.9 |
c | 80 | 2.0 | 98.9 |
d | 90 | 2.0 | 97.0 |
①该小组研究的反应条件是____________________和____________________。
②实验a和b的目的是__________________________________________________。
③在上述四组实验中,最佳的反应条件是__________℃和__________h。
④为了提升设备利用效率和节约能源,可进一步优化反应条件测定粗碲沉淀率。若再设计对比实验,选择的反应条件还可以是__________(填选磺)。
A.80℃,1.5h B.80℃,2.5h C.70℃,2.0h D.95℃,2.0h
查看答案和解析>>
科目: 来源: 题型:
【题目】粗盐中除NaCl外还含有泥沙等杂质。初步提纯粗盐的实验流程如下:

(1)“滤渣”是粗盐中含有的______________________________。
(2)实验过程中多次用到玻璃棒,分别是:
第一次:____________________________________________________________;
第二次:____________________________________________________________;
第三次:蒸发结晶时不断搅拌,防止液体和固体小颗粒飞溅;
第四次:将粗盐从蒸发皿转移出来。
(3)本实验从滤液得到精盐,采用的是蒸发溶剂的方法而不用降低溶液温度的方法,参照所给溶解度曲线图分析其原因是:__________________________________________________。

(4)看图可知,20℃时NaCl的溶解度为__________g,本实验溶解5.4g的粗盐,蒸馏水的最佳使用量约为__________ml(水的密度为1g/mL)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室部分装置如图所示,请回答下列问题。

选用试剂 | 发生装置 | 收集装置 |
H2O2溶液、MnO2 | _____________ | ____________ |
KMnO4 |
(2)如果用MnO2与浓H2SO4加热制备O2,可选用的发生装置是__________(填字母)。
(3)选用F装置收集气体时,下列实验操作正确的是__________(填序号)。
①反应前,将集气瓶注满水,用玻璃片盖着瓶口,倒立在盛水的水槽中
②开始反应后,等到气泡连续且均匀时,再将导管口移入集气瓶
③收集气体后,将集气瓶盖上玻璃片再移出水槽
(4)实验室用KMnO4制备O2的化学方程式是______________________________。若需制备3.2g O2,至少需要消耗__________g KMnO4。(已知KMnO4的相对分子质量为158)
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学做了以下两个实验:

(1)实验1中澄清石灰水的现象是________________________________________。产生此现象的原因是(用化学方程式表示)__________________________________________________。
(2)实验2中澄清石灰水的现象是________________________________________。产生此现象的原因是(用文字表述)__________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2017年《科学报告》一篇文章称,只需在普通口罩上添加氯化钠涂层,就能将其转化为“特效口罩”。口罩使用过程中,涂层中的氯化钠会溶解于病毒自身携带的水中,形成溶液,杀死病毒;杀死病毒后,水分蒸发,氯化钠再次析出。
(1)钠原子转化为钠离子,其核外电子数__________(填“变大”或“变小”),常温下,氯化钠的饱和溶液中,氯化钠与水的质量比为__________(已知:常温下,氯化钠的溶解度为36g)。
(2)构成氯化钠的阳离子符号为__________,口罩使用过程中,氯化钠溶液中溶质质量分数__________(填“改变”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
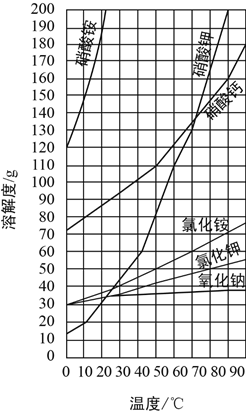
【题目】一些物质的溶解度同线如图,回答下列问题:
(1)70℃时,在100g水中加入110g硝酸钾固体,所形成的溶液是__________溶液(填“饱和”或“不饱和”)。
(2)将上述溶液降温到10℃时,析出的晶体质量是__________g。
(3)工业上将硝酸钾和氯化钠的热混合溶液(两者均已达饱和)冷却至室温,析出晶体。
①析出的晶体含有的物质是____________________(填化学式)。
②关于剩余溶液,下列说法正确的是__________。
A.只含有氯化钠,不含硝酸钾,且氯化钠达到饱和
B.含有氯化钠,又含有硝酸钾,且只有氯化钠达到饱和
C.含有氯化钠,又含有硝酸钾,且两者都达到饱和
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com