
【题目】向20g,铜锌合金中不断加入一定溶质质量分数的稀盐酸,加入稀盐酸的质量与固体质量的关系如图所示。请计算:
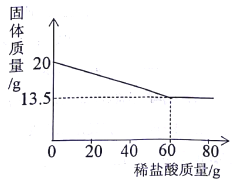
(l)合金中锌的质量分数为____。
(2)所用稀盐酸的溶质质量分数为_____________。(计算结果保留一位小数)
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:初中化学 来源: 题型:
【题目】如图是 NH4Cl、NaCl和 NaHCO3三种物质的溶解度曲线。

(1)易溶物质是______________,可溶物质是_____________,
(2)30℃时,NaHCO3的溶解度是_________,该温度下,向100g水中加入40 gNaHCO3,所得溶液中溶质与溶液的质量比为__________
(3)下列说法正确的是_______________。
A.NH4Cl饱和溶液一定比不饱和溶液浓
B.饱和NaCl溶液析出晶体后,溶液中溶质的质量分数可能不变
C.30℃,分别将10 gNaCl和10gNH4Cl配制成饱和溶液,前者需要水的质量较多
D.40℃,分别将NaCl和NH4Cl的饱和溶液降温到20℃时,后者析出的晶体较多
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】石油是经济发展、国防建设的重要资源。从石油炼制的产品中可以获得一系列与甲烷结构相似的化合物,如乙烷[C2H6]、丙烷[C3H8]、丁烷[C4H10]等。
(1)甲烷是一种①无色、无味的气体,②难溶于水,③在1500℃以上的高温下能分解为碳和氢气,④充分燃烧后生成二氧化碳和水。以上叙述中属于甲烷物理性质的是__________________(选填序号)。
(2)请模仿甲烷在氧气中充分燃烧的化学方程式,写出丙烷在氧气中充分燃烧的化学方程式:_____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氨气的水溶液称为氨水,呈碱性,易挥发,有强烈的刺激性气味。某兴趣小组利用浓氨水和浓盐酸探究分子运动速度与相对分子质量的关系。
方案I:在两玻璃片上同时分别滴加少量相同体积的浓氨水和浓盐酸,将2张湿润的pH试纸分别置于距玻璃片上方15厘米处(如图甲),比较2张pH试纸变色的时间。
方案II:将一支约35厘米长的玻璃管水平放置,将一湿润的pH试纸置于玻璃管的中间。在玻璃管两端同时分别滴加2滴浓氨水和浓盐酸后,迅速塞上橡皮塞(如图乙),观察pH试纸的颜色变化。
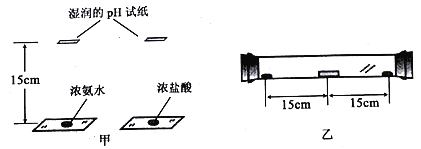
(1)方案I实验中,观察到两液滴间的上方出现白烟。针对此现象,你的合理猜想是________。
(2)请指出方案I的两点不足之处________。
(3)多次进行方案II的实验,均观察到试纸先变蓝色,得出相对分子质量越小分子运动速度越快的结论。为使该结论更具有普遍性,还应继续研究_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】征服原子——揭开原子的神秘面纱
伟大的科学家费曼说:“假如只允许把人类的科学史压缩成一句话,它就会是——一切东西都是由原子构成”。人类在探索物质是由什么构成的历史长河中,充满了智慧。
(1) 1803年,近代化学之父,英国科学家道尔顿(Dalton J)在前人研究的基础上,提出“道尔顿原子论”:一切物质都由原子构成,原子很小、呈圆球状、不可再分……但由于受当时实验条件限制,道尔顿无法用事实证明自己的观点。
1811年,意大利化学家阿伏伽德罗提出:有些物质也是由分子构成,原子的基本工作形式是分子。
1897年,汤姆森通过实验发现了___________,进一步发展了原子、分子论。汤姆森主要是纠正了“道尔顿原子论” _________中的观点。
1911年,卢瑟福又通过实验,推测原子是由_________构成,并提出了沿用至今的现代原子结构理论。
(2)道尔顿的原子论,不是事实的归纳,而是思维的产物,体现了直觉和想象在科学创造中的作用。在科学研究中,像汤姆森和卢瑟福这样.对实验现象进行解释的过程叫做____。
原子是一种看不见、摸不着的微粒,为了帮助人们理解原子的结构,这三位科学家都运用了 _________来表达他们的理论成果。
阅读下面材料,回答12-15题。
人类赖以生存的环境由自然环境和社会环境组成。自然环境由生物圈、岩石圈、大气圈、水圈组成(如图所示),四个圈层经过漫长演化,既相对稳定、动态平衡,又相互作用、不断变化,各圈层之间的物质和能量不停循环,这些循环既跟物质的组成、结构和性质有关,也受人类活动的影响,并通过复杂的物理变化和化学变化实现。
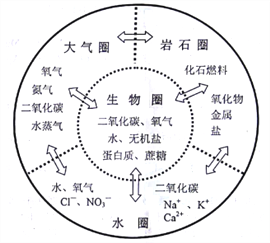
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】大理石是含杂质的碳酸钙,因具有美丽花纹面被广泛用于建筑物外墙、内壁的贴面和地面铺设。某同学想测出大理石样品中碳酸钙的含量,进行了如下实验和分析。
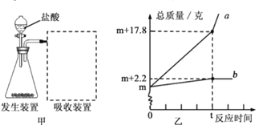
(1)取一定量的大理石样品置于图甲的发生装置中,用分液漏斗向下滴加盐酸(杂质不参加反应),产生的气体用含有碱性物质的吸收装置充分吸收。分液漏斗中所加液体不选用硫酸,理由是_______________。
(2)反应前,测得图甲中锥形瓶内物质的总质量和吸收装置的总质量都为m克,实验后,根据实验数据绘了图乙,曲线a、b分别表示锥形瓶内物质的总质量和吸收装置的总质量随反应时间变化的情况。请根据曲线b分析计算出大理石样品中碳酸钙的质量______________。
(3)请综合分析曲线a、b,计算出实验中所用盐酸的溶质质量分数为___________。(结果精确到0.1%)
(4)计算后,该同学对上述实验进行了反思。他认为分液漏斗中选用的盐酸浓度偏大,会对实验结果造成较大影响,其原因是______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某工厂产生的废渣主要成分是含钙的化合物(杂质为Fe2O3)。用该废渣制取CaCl2晶体(CaCl2·xH2O)并进行组成测定,其制取的流程如下图所示:
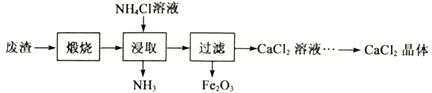
已知:NH4Cl溶液显酸性,且浓度越高酸性越强
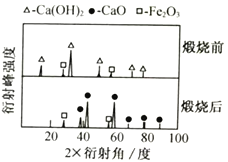
(1)XRD图谱可用于判断某固态物质是否存在。右图为煅烧前后废渣的XRD图谱。写出煅烧时发生的化学反应方程式________________________________。
(2)浸取时需连续搅拌,其目的是_________________;生成的NH3能使湿润的红色石蕊试纸变____________色。
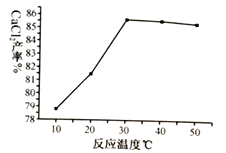
(3)在其它条件相同的情况下,CaCl2的产率随浸取温度的变化如下图所示。则宜选择的浸取温度为____________℃左右。
(4)若使用过量浓度较高的NH4Cl溶液,则所得CaCl2溶液中会含有NH4Cl、_______(填化学式)等杂质。
(5)过滤得到的Fe2O3在高温下可与CO反应,写出该反应的化学方程式____________。
(6)测定晶体(CaCl2·xH2O)的组成:
a.称取14.7000g CaCl2晶体于锥形瓶内,加入适量蒸馏水.使其全部溶解。
b.再向其中加入足量的Na2CO3溶液,静置。
C.过滤、洗涤、干燥、称量,得到10.0000g固体。
①通过计算,确定x的值(写出计算过程)。______________________。
②判断步骤b中沉淀完全的方法是:静置,向上层清液中滴加__________,则说明已沉淀完全;若沉淀不完全,则测得的x值比实际值______(填“偏大”、“偏小”或“ 不变”。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图像能符合题意反映对应变化关系的是________;
A.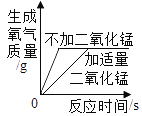 加热等质量的氯酸钾
加热等质量的氯酸钾
B. 通电分解水
通电分解水
C.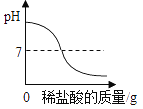 向一定量的氢氧化钠溶液中逐渐加入稀盐酸
向一定量的氢氧化钠溶液中逐渐加入稀盐酸
D.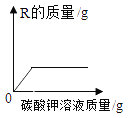 将一定量含有盐酸的氯化钙溶液中逐渐加入碳酸钾溶液,则图中物质R是________。
将一定量含有盐酸的氯化钙溶液中逐渐加入碳酸钾溶液,则图中物质R是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某氯化钠样品中含有氯化镁。为测定其中氯化钠的质量分数,称量5.00g样品于烧杯中,加适量水完全溶解,然后逐滴加入氢氧化钠溶液至恰好完全反应,生成0.58g沉淀。请回答下列问题:
(1)氢氧化钠溶液可使紫色石蕊溶液变成_____色。
(2)计算该样品中氯化钠的质量分数为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com