
【题目】取一定质量的碳酸钙,高温加热一段时间后,得到氧化钙和碳酸钙的固体混合物,其中碳、氧元素质量比为3:14,那么该固体混合物作氧化钙和碳酸钙的质量比为_________;取该固体混合物25.6g.加入溶质质量分数10%的稀盐酸219g,恰好完全反应。将所得溶液蒸发、结晶,最后得到固体的质量为_________g。
【答案】 7:25 33.3
【解析】氧化钙和碳酸钙的固体混合物,其中碳、氧元素质量比为3:14=12:56,由化学式可知,含12份质量的碳元素的碳酸钙中氧元素的质量为48份质量,碳酸钙的质量为100份质量,则氧化钙中氧元素的质量为(56-48)=8份质量,含8份质量的氧元素的氧化钙的质量为56![]() 2=28份,故固体混合物作氧化钙和碳酸钙的质量比为28:100=7:25;稀盐酸与碳酸钙和氧化钙反应都生成氯化钙,219g 10%的稀盐酸中溶质的质量为219g
2=28份,故固体混合物作氧化钙和碳酸钙的质量比为28:100=7:25;稀盐酸与碳酸钙和氧化钙反应都生成氯化钙,219g 10%的稀盐酸中溶质的质量为219g![]() =21.9g,21.9g的氯化氢中氯元素的质量为21.9
=21.9g,21.9g的氯化氢中氯元素的质量为21.9![]() =21.3g,含氯元素21.3g的氯化钙的质量为21.3g
=21.3g,含氯元素21.3g的氯化钙的质量为21.3g![]() =33.3g。
=33.3g。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:初中化学 来源: 题型:
【题目】如图所示的四个图象,能正确反映对应变化关系的是

A. ①向硫酸钠溶液中不断加入氯化钡溶液
B. ②向盐酸、氯化钙混合溶液中逐滴加入纯碱溶液
C. ③向等质量的锌粉、铁粉中分别加入足量同种稀硫酸
D. ④向一定温度的饱和氢氧化钙溶液中不断加入氧化钙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】室温为25℃时,某小组用无水氯化铜粉末制备氯化铜大晶体,制备过程如下:
步骤I:查阅资料,得到氯化铜溶解度数据如下
温度(℃) | 0 | 20 | 25 | 40 | 50 | 60 | 80 |
溶解度(g) | 69.2 | 74.5 | 76.4 | 81.8 | 85.5 | 89.4 | 98.0 |
步骤Ⅱ:配制少量CuCl2热饱和溶液,冷却结晶,得到晶种。
步骤Ⅲ:把晶种悬挂在新配制的CuCl2热饱和溶液中,室温下静置数天,形成大晶体。
步骤Ⅳ:取出大晶体,处理剩余的溶液(母液)。
根据以上信息,回答下列问题:
(1)用20mL蒸馏水(密度约为1g/mL)配制50℃的氯化铜饱和溶液。
①计算需称取CuCl2的质量是_______g。
②将称取的CuCl2固体和20mL水倒入烧杯中,_______________(填操作名称),直至固体完全溶解。
(2)母液中Cu2+属于重金属离子,随意排放将导致环境污染。下列方法可用于母液处理的是__________。
A.收集母液于敞口容器中,用报纸包住容器口,待水分自然蒸干后保存所得固体
B.向母液中加入适量AgNO3,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
C.向母液中加入适量NaOH,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
(3)若用铁粉置换出母液中的铜,100g母液需要铁粉的质量至少是_____________ g(只列计算式,已知CuCl2的相对分子质量为135)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列是初中化学常见的实验或操作,回答下列问题:
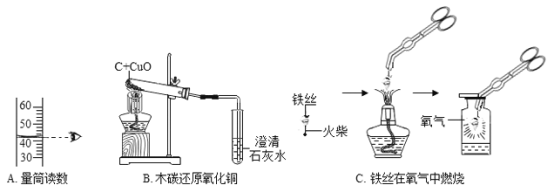
(1)A实验中读出液体的体积是_____________mL。
(2)B实验中看到的实验现象:___________________________________。
(3)C实验中把铁丝盘成螺旋状的目的是_________________,铁丝燃烧的化学方程式___________________________________。
(4)为测定钢铁中的含碳量,设计如下装置。钢铁样品在装置A中煅烧时,气体产物只有CO2和SO2(已知高锰酸钾溶液能够吸收二氧化硫气体)。
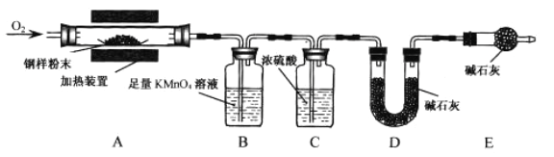
装置C的作用为_____________;若无装置C,则测定结果_____________(填“偏大”“无影响”或“偏小”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图甲是铝元素在元素周期表中的相关信息,图乙是几种微粒的结构示意图,仔细分析答题:
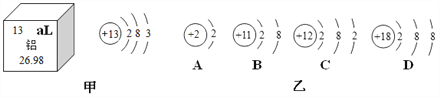
(1)图甲中,铝元素的信息有处错误,请加以改正_________;
(2)铝原子的相对原子质量_________ ;
(3)图乙中,属于稳定结构的原子是____(填序号,下同);
(4)图乙中,与铝不属于同一周期元素的是_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】20℃时,将10g固体甲加入到盛有50g水的烧杯中,充分搅拌后如图①;再加入xg固体甲,现象如图②;改变温度至t2℃,现象如图③。请结合图示回答下列问题。

(1)图④中表示固体甲的溶解度曲线的是__________(选填“A”或“B”)。
(2)图①、②、③中溶液一定是饱和溶液的是__________
(3)当x=__________g时,②中恰好没有固体剩余,且溶液为饱和溶液,此吋溶液中溶剂和溶质的质量比为__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是实验室制取气体的常用装置。
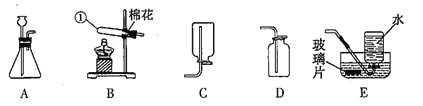
(1)仪器①的名称是______;
(2)选择恰当的装置,可用来加热高锰酸钾制取氧气,发生反应的化学方程式为______;用E装置收集氧气时,待集气瓶里的水排完后,_____,再小心地把集气瓶移出水槽,正放在桌面上。
(3)实验室制取二氧化碳气体,应选择的发生装置和最佳收集装置是_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】学习了二氧化锰对过氧化氢分解有催化作用的知识后,某兴趣小组同学在课外进行了有关过氧化氢分解反应的再探究。
(查阅资料)催化剂指的是能够改变化学反应的速率而自身的质量和化学性质在化学反应前后均不发生变化的物质。
(探究一)影响过氧化氢分解速率的因素有哪些?
兴趣小组同学做了四个实验,实验数据如下表:
实验 序号 | H2O2溶液的溶质质量分数% | H2O2溶液的体积/mL | 温度/℃ | MnO2的用量/g | 收集O2的体积/mL | 反应 时间 |
① | 5 | 1 | 20 | 0.1 | 4 | 16 s |
② | 15 | 1 | 20 | 0.1 | 4 | 6 s |
③ | 30 | 5 | 35 | 0 | 4 | 98 min |
④ | 30 | 5 | 55 | 0 | 4 | 20min |
(1)过氧化氢分解速率与温度的关系是__________。
(2)能说明过氧化氢的分解速率与其质量分数有关的实验是__________(填实验序号)。
(探究二)MnO2的聚集状态是否影响其催化效果?
将质量相同但聚状态不同的MnO2分别加入到5mL5%的H2O2溶液中,测试结果如下:
MnO2的状态 | 操作情况 | 观察结果 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 |
块状 | 反应较慢,火星红亮但木条未复燃 |
由上述实验得到的结论是__________。
(探究三)其他金属氧化物能否起到类似MnO2的催化作用?
兴趣小组同学用天平称量0.2gCuO,用量筒量取5mL5%的H2O2溶液,进行如下图所示实验(①~⑦代表实验操作步骤)。

(1)小组同学通过上述实验得出结论:CuO可作过氧化氢分解的催化剂,支持该结论的实验证据是__________。
(2)过氧化氢能被CuO催化分解放出氧气的化学反应方程式为__________。
(3)欲比较不同催化剂CuO和MnO2对H2O2分解速率的影响,实验时需要控制的变量有__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据如图实验装置回答下列问题。
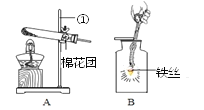
(1)仪器①名称是______。写出用装置A制取氧气的化学方程式_____。该装置能否由于实验室制取二氧化碳?_______。
(2)研究显示:O2的体积分数大于36%时就可使带火星的木条复燃。因此,O2验满时采用使带火星的木条复燃的方法______(填“可靠”或“不可靠”)。为了收集一瓶较纯净的O2,最好采用的方法是______。
(3)将收集到的氧气用来做铁丝燃烧的实验,如图B,此装置存在着缺点,你的改进措施是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com