
【题目】以菱锌矿(主要成分是ZnCO3,杂质为Fe2O3、FeO、CuO)为原料制备七水硫酸锌(ZnSO47H2O),同时得到铁红副产品,其工艺流程如图,回答下列问题:
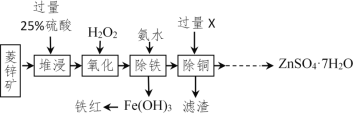
(1)“堆浸”前将菱锌矿粉粹成细颗粒,其目的是_____________________;
(2)若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要98%的硫酸质量为_____g(列出算式即可),需要用到的玻璃仪器有胶头滴管、玻璃棒、烧杯和________,此处玻璃棒的作用是____;
(3)物质X是___________,除铜时发生的反应属于________________反应(填基本反应类型);
(4)“氧化”中加入H2O2的目的是在硫酸的作用下将溶液中的FeSO4转化成Fe2(SO4)3,反应的化学方程式:_______________。
(5)流程中获得七水硫酸锌前省略的操作是______________、冷却结晶、过滤、洗涤和低温烘干;
(6)除铁过程中,反应温度、溶液pH对除铁效果均有影响,为探究除铁的最佳效果,某同学做了以下的实验并记录了相关数据,请回答问题:
编号 | 反应温度/℃ | 溶液pH | 除铁率/% |
a | 30 | 2 | 91.5 |
b | 30 | 2.5 | 93.3 |
c | 40 | 2.5 | 95.1 |
d | 40 | 3.1 | Y |
e | 50 | 3.1 | 99.5 |
①实验____和实验_____对比,得到的结论为其他条件不变时,反应温度增大,除铁率提高;
②实验a和实验b对比,得到结论是____________;
③表中Y的值可能为_____________(填编号)
A 93.4 B 94.1 C 97.8 D 99.6
④最佳的除铁条件为反应温度______℃,溶液pH_________。
【答案】增大反应接触面积,让反应速率更快,反应更充分; ![]() 或51; 量筒; 搅拌,加速热量的扩散,防止局部温度过高造成暴沸或液滴飞溅 锌或Zn, 置换; 2FeSO4 + H2SO4 + H2O2====Fe2(SO4)3 + 2H2O。 蒸发浓缩 b c; pH增大,除铁率提高 C 50, 3 .1。
或51; 量筒; 搅拌,加速热量的扩散,防止局部温度过高造成暴沸或液滴飞溅 锌或Zn, 置换; 2FeSO4 + H2SO4 + H2O2====Fe2(SO4)3 + 2H2O。 蒸发浓缩 b c; pH增大,除铁率提高 C 50, 3 .1。
【解析】
(1)“堆浸”前将菱锌矿粉粹成细颗粒,其目的是:增大反应物的接触面积,加快反应的速率;
故填:增大反应接触面积,让反应速率更快,反应更充分;
(2)溶液稀释前后溶质质量不变 , 所以需要 98% 的硫酸质量为 200g×25%![]() 98% ,需要用到的玻璃仪器有胶头滴管、玻璃棒、烧杯和量筒,此处玻璃棒的作用是搅拌,加速热量的扩散,防止局部温度过高造成暴沸或液滴飞溅;故填:200g×25%
98% ,需要用到的玻璃仪器有胶头滴管、玻璃棒、烧杯和量筒,此处玻璃棒的作用是搅拌,加速热量的扩散,防止局部温度过高造成暴沸或液滴飞溅;故填:200g×25%![]() 98%或51;量筒;搅拌,加速热量的扩散,防止局部温度过高造成暴沸或液滴飞溅
98%或51;量筒;搅拌,加速热量的扩散,防止局部温度过高造成暴沸或液滴飞溅
(3)锌和硫酸铜反应生成硫酸锌和铜,所以物质 X 是锌,除铜时发生的反应属于置换反应;故填:锌或Zn;置换
(4)硫酸亚铁、硫酸和过氧化氢在反应生成硫酸铁和水 , 化学方程式为: 2FeSO4+H2SO4+H2O2 ═ Fe2(SO4)3+2H2O ;故填:2FeSO4 + H2SO4 + H2O2====Fe2(SO4)3 + 2H2O
(5)获得七水硫酸锌前省略的操作是:蒸发浓缩、冷却结晶、过滤、洗涤和低温烘干;故填:蒸发浓缩
(6)①实验 b 和实验 c 对比,得到的结论为其他条件不变时,反应温度增大,除铁率提高;故填:bc
②实验 a 和实验 b 对比,得到结论是 pH 增大,除铁率提高;故填:pH 增大,除铁率提高;
③表中 Y 的值应该大于 95.1 ,小于 99.5 ,故选: C
④最佳的除铁条件为反应温度 50 ℃,溶液 pH3.1 ,除铁率最高。故填:50 , 3.1


科目:初中化学 来源: 题型:
【题目】用久置的镁条做实验时,需要用砂纸把表面的灰黑色物质磨掉,直到露出光亮的银白色。化学兴趣小组的同学对镁条表面“灰黑色外衣”的成分产生了浓厚兴趣。
(提出问题)镁条表面“灰黑色外衣”的成分是什么?
(作出猜想)
Ⅰ.是镁与空气中的氧气反应生成的氧化镁。
Ⅱ.是镁与空气中的二氧化碳反应生成的黑色碳单质。
Ⅲ.根据铜锈的成分是碱式碳酸铜,推测镁在潮湿的空气中生锈得到的碱式碳酸镁[Mg2(OH)2CO3]。
同学们经讨论,从颜色上否定了只含氧化镁,因为氧化镁是_____
(查阅资料)
①碱式碳酸镁受热可分解,常温下能与稀硫酸反应
②碳不与稀硫酸反应,但与浓硫酸在加热条件下能反应生成CO2、SO2和H2O
(进行实验)
实验一
实验装置 |
|
实验现象与结论 | ①无水硫酸铜粉末逐渐由白色变为蓝色,证明有_____生成②澄清石灰水变浑浊,反应方程式为 |
实验二
实验一试管内物质充分反应并冷却后,向其中加入足量稀硫酸,有气泡产生,但试管底仍有黑色固体。请写出产生气体的化学方程式_____。
实验三
将实验二反应后试管中的混合物进行过滤,弃去滤液,取滤渣加入浓硫酸,加热,固体全部溶解,得澄清溶液并伴有刺激性气味的气体产生。写出化学反应方程式_____。
(得出结论)据上述探究过程,可知久置镁条表面的灰黑色物质含有,不能确定是否含有的物质是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2018年5月9日,我国“高分五号”卫星发射成功。“高分五号”是我国首颗对大气中二氧化硫,二氧化氮、二氧化硫,甲烷等多个环境要素进行监测的卫星。

(1)高氯酸钾(KClO4)可用作固体火箭燃料,其中氯元素的化合价为______。
(2)“高分五号”用钛镍形状记忆合金制作卫星天线。钛镍合金是______(“化合物”或“混合物”)。如图是镍的原子结构示意图,X的数值是______。
(3)镍和铁一样也能与稀盐酸反应生成氢气,同时生成NiCl2,请设计实验比较镍与铁的金属活动性强弱______。
(4)作为新时代的主人翁,你对防治大气污染有哪些建议和好的举措,请简要说出一点______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,某兴趣小组在进行酸碱中和反应的实验探究时,向烧杯中氢氧化钠溶液中滴加稀盐酸一会儿后,发现忘记滴加指示剂,甲同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞溶液,振荡,观察到酚酞溶液不变色。
请写出该中和反应方程式:___________________________________________________。
(1)猜想与假设:
猜想一:甲同学:“两种物质已恰好完全中和,溶液呈中性”;
猜想二:乙同学:“反应后氢氧化钠过量,溶液呈碱性”;
猜想三:丙同学:__________________________________________________________。
甲、丙两位同学经过讨论后觉得乙同学的猜想不正确,两位同学的理由是:_______________________。
(2)设计并进行实验:
①为了验证自己的猜想,甲同学设计了以下实验方案:
实验步骤 | 实验现象 | 实验结论 |
用洁净干燥的玻璃棒蘸取少量反应后的溶液滴在干燥的pH试纸上,观察颜色变化并与标准比色卡对比。 | pH________(填“>”“=”或“<”)7 | 猜想一不成立 |
②请你设计另一个实验(与甲同学方案不同)方案,验证丙同学的猜想,并填写下表:
实验步骤 | 实验现象 | 实验结论 |
__________ | __________ | __________ |
(3)拓展探究:你还能设计不同的实验方案来验证丙同学的猜想吗?
实验步骤 | 实验现象 | 实验结论 |
__________ | __________ | __________ |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】稀NaOH溶液与稀盐酸反应过程中温度和pH的变化如图所示。下列说法正确的是( )
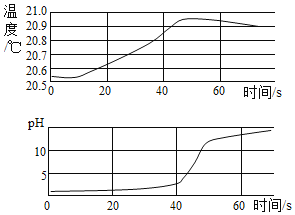
A. 该实验是将稀盐酸滴入稀NaOH溶液
B. 稀NaOH溶液与稀盐酸反应为吸热反应
C. 在40s到50s某时刻,两溶液恰好完全反应
D. 在温度达到最高值前,溶液中只有![]() 和
和![]() 两种离子
两种离子
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将过量的Na2CO3溶液滴入到一定量CuSO4溶液中得到蓝色固体。某研究性学习小组对蓝色固体的成分进行了如下探究,通过查阅资料得知CuCO3在水溶液中不能单独存在,请完成下列各题:
(一)猜想与假设:
猜想一:固体不可能为CuCO3。
猜想二:固体为Cu(OH)2,理由:Na2CO3溶液呈_____(填“酸”或“碱”)性。
猜想三:固体为Cu(OH)2和CuCO3的混合物。
(二)资料查阅:
①Cu(OH)2和CuCO3晶体均不带结晶水,无水CuSO4为白色固体,易吸水变蓝;
②Cu(OH)2![]() CuO+H2O;CuCO3与CaCO3类似,受热易分解
CuO+H2O;CuCO3与CaCO3类似,受热易分解
③铜元素在化合物中的主要价态有+1、+2
(三)设计与实验:
Ⅰ.用下图所示装置,定性探究蓝色固体的成分。
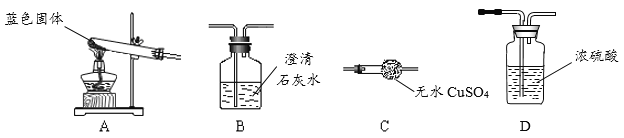
该小组同学将装置按_____(填字母)的顺序组合进行实验,B中的现象为_____,C中的现象为_____。从而验证出猜想三是正确的。
Ⅱ.固体成分定量测定:
已知Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃。设固体的组成为aCu(OH)2bCuCO3。小组同学用热分析仪对固体进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如图,请根据图示回答下列问题:
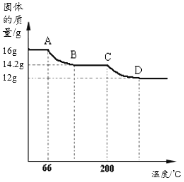
(1)通过计算可得:a:b=_____。
(2)若将12.0g剩余固体继续加热到更高的温度,发现固体质量减少了1.2g后质量不再改变,写出此过程中可能发生反应的化学方程式:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是实验室常用的实验装置,请根据要求回答下列问题。
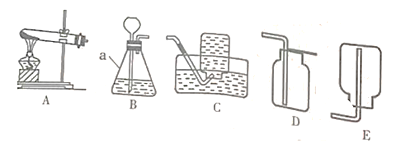
(1)写出图中a仪器的名称:_________。
(2)实验室加热氯酸钾和二氧化锰制取并收集氧气应选择的装置是_________(填序号),若用排空气法收集氧气,检验氧气是否收集满的方法是__________。
(3)实验室用装置B制取二氧化碳的化学方程式为_________;装置B中的长颈漏斗的下端管口应插入液面下,目的是_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组的同学,为了比较金属R与铁、铜的金属活动性强弱,进行如下探究活动:
[查阅资料]铁的活动性比铜强.
[进行猜想]对三种金属的活动性顺序做出如下猜想:
猜想一:R>Fe>Cu; 猜想二:_______________; 猜想三:Fe>Cu>R
[收集证据]为了验证哪一种猜想成立,甲、乙、丙三位同学分别展开实验探究.
主要操作 | 主要现象 | 实验结论 | |
甲 | 将打磨好的R丝插入盛有硫酸铜溶液的试管中 | ______________ | 猜想一 正确 |
乙 | 将粗细相同打磨好的R丝、铁丝,分别插入体积和溶质质量分数都相同的稀盐酸中 | R丝表面产生气泡速率比铁丝表面产生气泡速率___(填“快”或“慢”) | |
丙 | 将粗细相同打磨好的R丝、铁丝,分别在空气中点燃 | R丝在空气中剧烈燃烧,铁丝在 空气中______ |
写出铁丝在氧气中燃烧的化学方程式__________________________________
[交流反思]三位同学交流讨论后认为,比较金属活动性强弱的方法有多种.
[归纳总结]他们总结得出比较金属活动性强弱的常见方法有:
(1)金属与氧气反应的难易和剧烈程度;
(2)金属与酸溶液是否反应或反应的剧烈程度;
(3)金属与_____是否反应.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D、E、F是初中化学常见的六种物质,已知A是一种单质,B为红棕色固体,D常用于改良酸性土壤,F与B属于同类物质。其相互反应情况如图所示(“一”表示相连的物质能发生反应,“→”表示一种物质能生成另一种物质)。

(1)A与C发生反应的基本反应类型为_____
(2)F转化为D的化学方程式为_____
(3)写出F的一种用途_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com