
【题目】取含有MgCl2和HC1的混合溶液165.8g于烧杯中,向其中缓慢加入200g溶质质量分数为8%的NaOH溶液,恰好完全反应后过滤得到沉淀和滤液,其中滤液的质量为360g。请计算:
(1)生成沉淀的质量是多少克。
(2)原混合溶液中,MgCl2的质量是多少?(请写出具体的计算过程,下同)
(3)恰好完全反应时,所得溶液的溶质质量分数是多少?(结果保留至0.1%)
【答案】(1)5.8g;(2)9.5g;(3)6.5%
【解析】
(1)根据质量守恒定律,化学反应前后,物质的总质量不变,故生成沉淀的质量是:165.8g+200g-360g=5.8g;
(2)设氯化镁的质量是x,消耗氢氧化钠的质量为y,生成氯化钠的质量为z
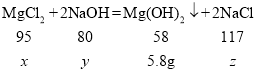
![]() x=9.5g
x=9.5g
![]() y=8g
y=8g
![]() z=11.7g
z=11.7g
(3)与稀盐酸反应的氢氧化钠的质量为:200g×8%-8g=8g
设稀盐酸与氢氧化钠反应生成氯化钠的质量为m
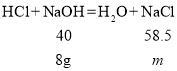
![]() m=11.7g
m=11.7g
恰好完全反应时,所得溶液的溶质质量分数是:![]() 。
。
答:(1)生成沉淀的质量是5.8克;
(2)原混合溶液中,MgCl2的质量是9.5g;
(3)恰好完全反应时,所得溶液的溶质质量分数是6.5%。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:初中化学 来源: 题型:
【题目】图中字母代表含硫元素的物质,下列判断错误的是
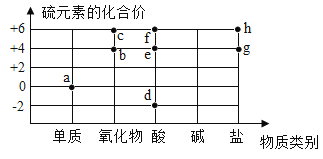
A.物质a在纯氧中燃烧可以生成物质b
B.物质c是二氧化硫
C.物质d中硫元素的化合价为-2价
D.物质d、e和f中一定那含有氢元素
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一瓶敞口放置的氢氧化钠固体,同学们想探究其是否变质,请你一同参与并回答有关问题。
(1)写出氢氧化钠在空气中变质的化学反应方程式___________________________。
(提出猜想)
猜想1:这瓶固体的成分是NaOH;
猜想2:这瓶固体的成分是_________;
猜想3:这瓶固体的成分是NaOH和Na2CO3的混合物。
(查阅资料)①Na2CO3+HCl=NaCl +NaHCO3;NaHCO3+HCl=NaCl +CO2↑+H2O;②BaCl2溶液呈中性;③酸与碱和盐共同反应时,酸碱中和反应优先进行。
(实验与探讨)
取少量样品于烧杯中,加入适量蒸馏水,振荡,样品全部溶解。
(2)取少量溶液于试管中,向其中加入无色酚酞溶液,溶液由无色变为红色。甲同学认为猜想1正确。乙同学认为甲同学的结论不正确,其理由是_____________________。
(3)向(2)溶液中加入过量的BaCl2溶液,若有________________现象,则猜想3正确。发生反应的化学方程式为_________________。
(4)丙同学另取少量溶液于试管中,加入少量稀盐酸,没有看到气泡产生,错误地排除了猜想2和猜想3,若猜想2或猜想3正确,加入稀盐酸发生反应的化学方程式分别为_________;___________。
(深入讨论)
(5)丁同学认为BaCl2溶液也可以用Ba(OH)2溶液替代进行实验,同学们一致认为丁同学的做法是错误的,其错误的理由是___________________________________________。
(6)通过氢氧化钠变质的研究可知,凡吸收空气中的H2O、O2或CO2等物质能够变质的药品必须密封保存,请列举另一类需要密封保存的药品的例子,如_______________________。
(7)取9.3g部分变质的NaOH样品,加入足量的水配成溶液,往溶液中不断加入7.3%的稀盐酸,实验中加入稀盐酸与生成气体的质量关系如图所示:
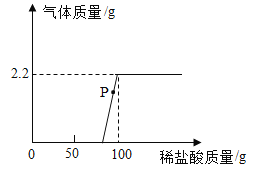
①P点溶液中溶质的成分是_______________(写化学式);
②该样品的变质率为_________(变质的NaOH与原NaOH的质量百分比)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室可利用Zn与稀硫酸的反应制取H2。
(1)用浓硫酸配制稀硫酸的操作为________(填字母),用玻璃棒引流,并不断搅拌。
A 将浓硫酸缓缓注入盛有水的烧杯中
B 水缓缓注入盛有浓硫酸的烧杯中
(2)Zn与稀硫酸反应的化学方程式为___________。
(3)图-1所示的仪器B、D的名称为__________、________,组装制取H2的发生装置应选用的仪器为_________(填字母)。

(4)为收集并准确测量H2的体积,在装入药品前,需检查装置的_______。
(5)相同条件下H2密度比空气小,利用该性质可以通过_________法收集H2,若用图-2所示装置测量生成H2的体积,H2应从____________(填“甲”或“乙”)管通入。
(6)为探究影响Zn与稀硫酸反应快慢的因素,进行以下三组实验,室温下,取颗粒大小相同的锌粒与足量的稀硫酸反应,测量产生10mLH2(通常状况)所需的时间,下表为实验数据:
实验编号 | 硫酸的质量分数/% | 硫酸的体积/mL | 锌粒的质量/g | 时间/s |
1 | 10 | 10 | 1 | 78 |
2 | 10 | 10 | 2 | 57 |
3 | 40 | 10 | 1 | 9 |
①比较实验1、2的数据,可以得出的结论是________。
②由实验数据可知,该实验中对Zn与稀硫酸反应快慢影响较大的因素是________。
③比较不同条件下锌粒与稀硫酸反应的快慢有不同的方法,除测量产生相同体积的H2所需的时间,还可采用的测量方法是___________(写出一种)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】建立宏观、微观和符号之间的相互联系是化学学科的特点。请根据信息回答下列问题:
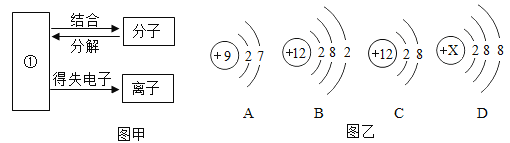
(1)图甲为粒子之间的转化关系图,其中①表示的是_____。
(2)图乙中D为某粒子的结构示意图,当X=___时,该粒子是原子。
(3)图乙中B、C属于同种元素,因为___相同。
(4)由A、B形成的化合物的化学式为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有一包固体样品,可能由氢氧化钠、硫酸钠、硝酸镁、硝酸铜、碳酸钙中的一种或几种物质组成。为确定该样品的组成,某兴趣小组同学取适量样品进行探究。探究过程如下:

根据以上信息判断,下列说法正确的是
A.白色沉淀 a 的成分是碳酸钙
B.该样品中一定存在氢氧化钠、硝酸镁、硫酸钠、碳酸钙,一定不存在硝酸铜
C.该样品中一定存在硫酸钠、碳酸钙、硝酸镁,一定不存在硝酸铜和氢氧化钠
D.若步骤①②保持不变,用硝酸钡溶液代替步骤③中的氢氧化钡溶液,则不需要进行步骤④的探究,也能确定该样品的组成
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】回收利用废旧金属具有重要意义。某机械厂金属废料的成分是 Zn、Cu、ZnO和 CuO,某化学小组利用该金属废料回收铜并制取氧化锌和硫酸铜。请回答下列问题。
(活动一)回收铜并制取氧化锌,实验方案如下:

(1)步骤 I 所得滤液 a 中溶质的成分是____(填写化学式)。
(2)步骤 III 加入试剂甲的名称是______。
(3)步骤 IV 加入适量 NaOH 溶液的目的是________。
(活动二)利用活动一回收的铜制取硫酸铜,设计方案如下:
方案 A: ![]()
方案 B: ![]()
(信息)
(4)方案 A 中氧化铜与稀硫酸反应的化学方程式为____。
(5)小组同学从绿色化学的视角分析方案 B 不合理,理由是____(写出一条即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】数据处理能及时获得更多的信息。下列图示中,不能正确反映化学原理及实验操作规范的是
A.加热一定质量的KClO3和MnO2的混合物
B.稀释浓硫酸
C.向PH=4的CuSO4溶液中滴加NaOH溶液
D.向足量相同质量分数的稀硫酸中分别加入等质量Zn粉、Al粉、Mg粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com