
【题目】在一定量AgNO3和Al(NO3)3的混合液中加入铜粉和锌粉,充分反应后过滤,得到溶液甲和固体乙,如图所示,则:

①固体乙中一定含有Ag,可能含有Cu和Zn
②溶液甲中一定含有Al(NO3)3和Zn(NO3)2
③若溶液甲是蓝色,则溶液甲中一定有Al(NO3)3、Cu(NO3)2和Zn(NO3)2
④若溶液甲是无色,则溶液甲中一定有Al(NO3)3、可能有Zn(NO3)2、一定没有Cu(NO3)2
⑤向固体乙滴加盐酸有气泡产生,则溶液甲中一定没有AgNO3和Cu(NO3)2
上述四种说法正确的个数为 ( )
A. 1个 B. 2个 C. 3个 D. 4个
【答案】D
【解析】金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au,在金属活动顺序表中,排在氢前边的金属能和酸发生置换反应生成盐和氢气。金属的位置越靠前,金属的活动性越强。位置靠前的金属能将位于其后的金属从它的盐溶液中置换出来。在一定量AgNO3和Al(NO3)3的混合液中加入铜粉和锌粉,锌先与硝酸银反应生成硝酸锌和银,然后铜与硝酸银溶液反应生成硝酸铜和银,但都不与硝酸铝反应,即溶液中一定有硝酸铝、硝酸锌,固体中一定有银。①当锌粉较多,只有锌与硝酸银发生反应且有剩余时,固体乙中一定含有Ag、Cu和Zn,当锌的量较少时,一定有银,铜和锌不确定,①正确;②由于锌一定能反应,故溶液甲中一定含有Al(NO3)3和Zn(NO3)2,正确;③若溶液甲是蓝色,说明溶液中有硝酸铜,则溶液甲中一定有Al(NO3)3、Cu(NO3)2和Zn(NO3)2,正确;④若溶液甲是无色,则溶液甲中一定有Al(NO3)3、Zn(NO3)2,一定没有Cu(NO3)2,错误;⑤向固体乙滴加盐酸有气泡产生,说明锌有剩余,硝酸银一定被反应完,则溶液甲中一定没有AgNO3,铜没有参与反应,溶液中一定没有Cu(NO3)2;故选D。


科目:初中化学 来源: 题型:
【题目】(1)人类使用的化石燃料主要是煤、石油和________________,直接燃煤会形成严重的酸雨,酸雨是指pH小于______________的降水;
(2)为减少温室气体二氧化碳的排放,可以将二氧化碳进行转化。下图为该反应的微观示意图,根据图示回答下列问题:
反应前 | 反应后 |
| ||
A | B | C | D | |
|
|
|
| |
①以上4种物质中属于有机化合物的是________________(填化学式);
②在反应中C与D质量比为____________________;
(3)氢能是理想的清洁能源。以太阳能为热源,经由铁氧化合物循环分解水的过程如图:
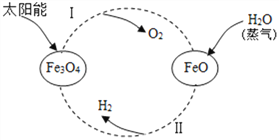
①反应Ⅰ的基本反应类型为___________________;
②写出在一定条件下发生的反应的Ⅱ化学方程式:_____________;
③在上述循环过程中,最终得到的产品是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“H茶”为芝士(奶酪,是一种发酵的牛奶制品)现泡茶的原创者。自创立以来,受到年轻人欢迎,让我国饮茶这一古老文化焕发出新的生命力。下列说法正确的是

A. 芝士的主要成分是蛋白质,蛋白质属于有机高分子化合物
B. 配制该饮料的橙子富含维生素C,缺乏该物质会引起夜盲症
C. 上图中塑料袋加热熔化,具有热固性
D. 茶叶中茶多酚化学式为C17H19N3O,该物质为无机物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“低钠盐”可以控制钠的摄入量从而防治高血压等疾病。制备“低钠盐”是在食盐中用NaCl按照配方比例添加食用KCl。国内某些生产厂家为改变“低钠盐”口味还会加入少量镁盐(仅限MgSO4或MgCl2)。
(1)测得某“低钠盐”样品a中只含有NaCl和KCl,该样品中的NaCl和KCl溶于
水时解离出的阴离子都是___________(填离子符号)。
(2)探究某“低钠盐”样品b中是否添加有镁盐,以及添加的是何种镁盐?
【猜想】I、不含镁盐 Ⅱ、含有硫酸镁 Ⅲ、含有氯化镁

【进行实验】
(3)请完成下表(已知BaSO4是难溶于水和酸的白色固体):
假设和现象 | 判断和化学方程式 | |
① | 若现象a为白色沉淀 | 则猜想____不成立。 |
② | 若现象a为_________, 现象b为_________。 | 则猜想Ⅲ成立。写出无色溶液B与硝酸中和反 应的化学方程式_________________。 |
③ | 若现象a、b均 为:产生白色沉淀 | 则猜想____成立。写出无色溶液B与硝酸钡溶液 反应的化学方程式______________。 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明同学用下图所示装置进行实验。甲瓶中充满二氧化碳气体,注射器中装有氢氧化钠浓溶液,乙中盛有足量稀盐酸。小明先关闭止水夹,然后将氢氧化钠浓溶液全部注入甲瓶,一段时间后再打开止水夹。
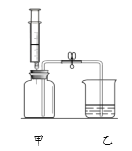
(1)注入氢氧化钠浓溶液后,甲中发生反应的化学方程式为_____________。
(2)打开止水夹,可观察到的现象有_____________、_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】近几年我国某些工业城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成的,此外,各种机动车排放的尾气也是形成酸雨的重要原因。
【提出问题】通过实验证明煤中含有碳元素和硫元素。
【查阅资料】(1)“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),该反应的化学方程式为:5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2 X 。 化学方程式中最后一种物质X的化学式是:__________。
(2)“二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊。”请写出二氧化硫与澄清石灰水反应的化学方程式:_____________________。
根据上述资料,甲同学、乙同学和丙同学分别设计实验方案进行探究。
【实验探究】(3)甲同学:“实验操作”:甲同学进行了如下图所示A、B两步实验:
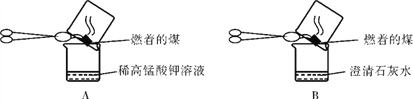
“实验现象”: A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊。“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
(4)乙同学认为甲同学的实验方案不合理,其理由是:_________________。
(5)丙同学:“实验操作”:丙同学进行了如下图所示实验(部分装置在图中略去):
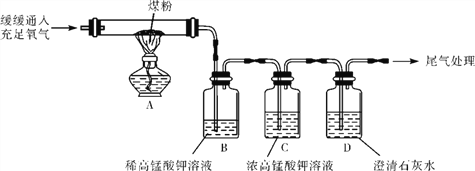
【探究与结论】(6)上图C装置的作用是____________________________________。
(7) 要证明煤中含有碳元素和硫元素的现象是:丙同学的实验中B中__________ ,C中的溶液不褪色,D中______________。
【定量计算】 (8)用石灰石浆也能吸收废气中的二氧化硫,其反应原理是:2CaCO3+O2+2SO2![]() 2CaSO4+2CO2 ,一座小型火力发电厂每天要燃烧100t煤炭,其中硫元素的质量分数约为6.4% 。
2CaSO4+2CO2 ,一座小型火力发电厂每天要燃烧100t煤炭,其中硫元素的质量分数约为6.4% 。
(1)如果尾气不处理,发电厂每月将向大气中排放_________吨SO2(按30天计算)?
(2)每天至少需要含80%碳酸钙的石灰石_________吨才能将其完全吸收?(写出解题过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学反应速率是衡量化学反应进行快慢的物理量,为了探究影响化学反应速率的因素,以过氧化氢分解为研究对象进行实验。各小组均可采用如图装置进行实验,记录收集10mL氧气的时间,实验室可供选择的试剂有:2.5%、5%、10%三种浓度的H2O2溶液、MnO2、CuO、红砖粉末。

A组:探究催化剂对化学反应速率的影响;
取5mL10%H2O2溶液,三次实验分别加人0.5gMnO2、红砖粉末、CuO进行实验,记录数据如下:
试剂 | MnO2 | 红砖粉末 | CuO |
t/s | 10 | 60 | 20 |
由此得出结论:MnO2、CuO对H2O2分解有催化作用,红砖粉末无催化作用。
(1)你认为该结论是否正确,为什么?_________________________________________。
(2)经过补充对比实验,证明红砖粉末有催化作用,则三者的催化效率由高到低的顺序为___________。
B组:探究浓度对化学反应速率的影响
甲同学:取10mL5%H2O2溶液,加入0.5gMnO2为催化剂,,进行实验,记录时间t1。
(3)乙同学:取10mL2.5%H2O2溶液,加入__________为催化剂,进行实验,记录时间t2。
实验结果:_______________________________________________________
结论:___________________________________________________________
【拓展探究】
(4)C组:探究____________对化学反应速率的影响。
各取10mL5%H2O2溶液和0.5gCuO为催化剂进行实验,两次实验分别将试管置于冰水浴和50℃热水浴,记录时间t3、t4。
(5)实验结果:_________________________;
结论:当反应物浓度和催化剂相同时,__________________________________。
(6)以上三组实验说明,影响化学反应速率的因素有:________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】兴趣组学生海边盐场参观,带回了部分粗盐样品,并对其进行了如下图探究:
(1)操作③的名称是______。
(2)操作③④中均用到玻璃棒,其作用分别为__________,_________。
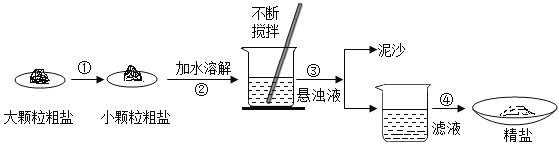
(3)用提纯得到的“精盐”配制100g 7.5%的氯化钠溶液.经检测,溶质质量分数偏小,其原因可能有______(填序号)
①氯化钠固体不纯 ②称量时精盐与砝码放反了 ③量取水时俯视读数 ④装瓶时,有少量溶液洒出
(4)查阅资料得知:粗盐中除含少量泥沙等不溶性杂质外,还含有少量的可溶性杂质(假定可溶性杂质只有MgCl2一种),为了得到较纯净的氯化钠,小组同学将所得的“精盐”又作了如下处理:
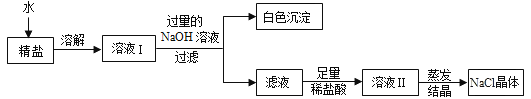
①白色沉淀的化学式为______.
②在得到的滤液中加入足量的稀盐酸的目的是______________________________.
③若实验过程中不考虑损耗,最终得到的NaCl固体的质量将______(填“大于”、“小于”或“等于”)原精盐中NaCl的质量.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为m的锌粉,溶液中析出固体的质量与参加反应的锌粉质量关系如图所示,下列说法中正确的是

A.c点对应溶液中含有的金属离子为Zn2+和Cu2+
B.bc段(不含两端点)析出的金属是Fe
C.ab段(不含两端点)对应溶液中含有的金属离子为Zn2+、Ag+、Cu2+、Fe2+
D.若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2,m1>m2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com