
| 实验步骤 | 现象 | 有关反应的化学方程式 |
| 要少量固体B,滴加 稀盐酸 | 有气泡产生 | Zn+2HCl═ZnCl2+H2↑ |
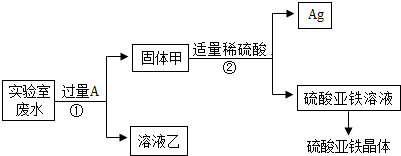
分析 【交流讨论】
锌和硝酸银反应生成硝酸锌和银,铁和硝酸银反应生成硝酸亚铁和银;
【实验探究一】
锌能和稀盐酸反应生成氯化锌和氢气;
【实验探究二】
因为需要得到硫酸亚铁晶体,因此加入的A应该是铁;
【实验探究三】
铜和银不如铁活泼,不能和硫酸亚铁反应;
①中,铁能和硫酸铜反应生成硫酸亚铁和铜,银不能和硫酸铜反应.
解答 解:【交流讨论】
不合理的猜想是②,其理由是:如果滤液中含有硝酸银,则铁和硝酸银反应生成硝酸亚铁和银,滤液中应该有硝酸亚铁.
故填:②;硝酸银能和铁反应生成硝酸亚铁和银.
【实验探究一】
若猜想①成立,则锌过量或恰好完全反应,如果过量时,锌和稀盐酸反应生成氯化锌和氢气,反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑.
故填:稀盐酸;Zn+2HCl═ZnCl2+H2↑.
【实验探究二】
(1)固体甲中含有的物质有过量的铁和反应生成的银;
溶液乙中含有硝酸锌和硝酸亚铁.
故填:Fe、Ag;Zn(NO3)2、Fe(NO3)2.
(2)步骤①中,铁和硝酸银反应的化学方程式为:Fe+2AgNO3=Fe(NO3)2+2Ag.
故填:Fe+2AgNO3=Fe(NO3)2+2Ag.
【实验探究三】
对Ag、Fe、Cu三种金属活动顺序的探究,下列所选试剂组不可行的是②,因为铜、银都不能和硫酸亚铁反应,因此只能够确定铁比铜和银活泼,不能确定铜和银的活泼性顺序;
①组可行,铁能和硫酸铜反应,银不能和硫酸铜反应,因此铁比铜活泼,铜比银活泼,其中铁和硫酸铜发生反应的化学方程式为:Fe+CuSO4═FeSO4+Cu.
故填:②;Fe+CuSO4═FeSO4+Cu.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| 操作一:取天然碱样品少量溶于足量水后,加入过量的CaCl2稀溶液(如果操作一有沉淀,则进行操作二) | 无沉淀出现 | 假设一成立 |
| 操作二:待操作一中反应充分后过滤,并在滤液中加入过量的Ca(OH)2溶液,观察. | 无沉淀出现 | 假设二成立 |
| 产生白色沉淀 | 假设三成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | H2 | 水蒸气 | 通过盛有氢氧化钠溶液的洗气瓶 |
| B | H2O | Mg(OH)2 | 过滤 |
| C | N2 | O2 | 通过炽热的木炭 |
| D | NaOH溶液 | Na2CO3 | 加入稀盐酸至不再产生气泡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CaCO3(NaCl) 加水,将固体溶解后过滤 | |
| B. | Cu粉(Fe粉) 加过量稀盐酸,充分反应后过滤 | |
| C. | KCI溶液(CuCl2) 加适量KOH溶液过滤 | |
| D. | CO2气体(SO2) 将气体通入盛有NaOH溶液的洗气瓶 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 水中Ca2+、Mg2+的增多会引起水体富营养化 | |
| B. | 电解水实验可证明水是由氢、氧两种元素组成 | |
| C. | 生活中可以用煮沸的方法能降低水的硬度 | |
| D. | 水经过“三态”变化实现在自然界中的循环 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | H2、CO | B. | CO2、CO | C. | H2、CH4 | D. | CO、CH4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com