
| A. | K2CO3 | B. | NH4NO3 | C. | Ca(H2PO4)2 | D. | NH4HCO3 |
科目:初中化学 来源: 题型:解答题
 A、B、C、D是初中化学常见的物质,能发生如图所示的转化关系.
A、B、C、D是初中化学常见的物质,能发生如图所示的转化关系.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
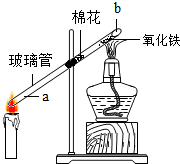
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 .钠在空气中极易被氧化,用小刀一切,就能观察到它的本来面目:银白色有金属光泽.钠还能与水反应,生成氢氧化钠和氢气.
.钠在空气中极易被氧化,用小刀一切,就能观察到它的本来面目:银白色有金属光泽.钠还能与水反应,生成氢氧化钠和氢气.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
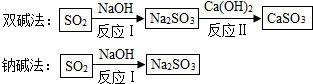
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.90 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
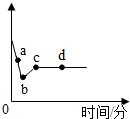 向一定质量AgNO3和Cu(NO3)2的混合溶液中加入一定量的Zn粉,溶液质量随反应时间变化的情况如图所示.下列说法正确的是( )
向一定质量AgNO3和Cu(NO3)2的混合溶液中加入一定量的Zn粉,溶液质量随反应时间变化的情况如图所示.下列说法正确的是( )| A. | 取a点溶液,滴加稀盐酸,无白色沉淀 | |
| B. | c点溶液中溶质为Zn(NO3)2 | |
| C. | 若取b~c段固体,滴加稀盐酸,无气泡产生 | |
| D. | 取d点的固体有2种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com