
【题目】元素周期表是化学学习的重要工具,下图是元素周期表的一部分,请认真观察分析并回答问题:
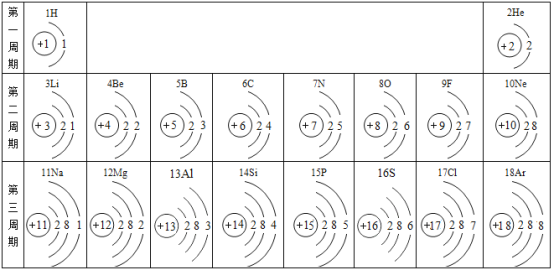
(1)元素周期表中的各种元素的本质区别是_____;决定元素化学性质的是_____
(2)决定元素所在的周期数的是_____第二周期元素的原子核外电子排布的规律是_____。
(3)F、Cl、S三种非金属元素的原子得电子能力逐渐增强,根据这三种非金属元素的原子结构推测:非金属元素的原子得电子能力的强弱主要与_____有关。
(4)水(H2O)、双氧水(H2O2)、重水(D2O,“D”表示原子核中有一个质子和一个中子的氢原子)三种物质,从物质组成的角度看,这三种物质所含的元素共有_____种,从化学性质的角度看,_____与水的化学性质有较大的差异。
(5)原子通过得失电子后可形成稳定粒子。核外有10个电子的粒子有:
①阳离子:_____;
②阴离子:_____;
③中性粒子:_____。
【答案】质子数(或核电荷数) 原子的最外层电子数 原子核外的电子层数 都有两个电子层,第一层都是2个电子,最外层电子数由1依次递增至8(合理即可) 外层电子数或电子层数或原子半径 两 双氧水(或H2O2) Na+、Mg2+、Al3+、NH4+ F-、O2-、OH- Ne、H2O、NH3、CH4
【解析】
(1)元素周期表中的各种元素的本质区别是质子数不同,决定元素化学性质的是最外层电子数,故填:质子数(或核电荷数);原子的最外层电子数。
(2)元素周期数等于核外电子层数,故决定元素所在的周期数的是原子核外电子层数,由表格可知,第二周期元素的原子核外电子排布的规律是都有两个电子层,第一层都是2个电子,最外层电子数由1依次递增至8,故填:原子核外的电子层数;都有两个电子层,第一层都是2个电子,最外层电子数由1依次递增至8(合理即可)。
(3)F、Cl、S三种非金属元素的原子得电子能力逐渐增强,根据这三种非金属元素的原子结构示意图推测:非金属元素的原子得电子能力的强弱主要与外层电子数或电子层数或原子半径有关,故填:外层电子数或电子层数或原子半径。
(4)水(H2O)、双氧水(H2O2)、重水(D2O),“D”表示原子核中有一个质子和一个中子的氢原子)三种物质,从物质组成的角度看,这三种物质都是由氢、氧元素组成,所含的元素共有两种,从结构看一个双氧水分子由两个氢原子和两个氧原子构成,一个水分子由一个氧原子两个氢原子构成,结构差异较大,结构相差较大化学性质差异较大,双氧水与水的化学性质有较大的差异,故填:两;双氧水(或H2O2)。
(5)原子通过得失电子后可形成稳定粒子。核外有10个电子的阳离子有:Na+、Mg2+、Al3+、NH4+;核外有10个电子的阴离子有:F-、O2-、OH-;核外有10个电子的中性粒子有:Ne、H2O、NH3、CH4(合理即可),故填:Na+、Mg2+、Al3+、NH4+;F-、O2-、OH-;Ne、H2O、NH3、CH4。


 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:初中化学 来源: 题型:
【题目】如图是 a、b、c 三种固体物质的溶解度曲线,下列叙述正确的是( )
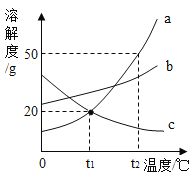
A.三种固体物质的溶解度大小关系为 a>b>c
B.t1 ℃时,将 30 g 的固体 a 加入 50 g 水中,所得溶液的溶 质质量分数约为 16.7%
C.c 的饱和溶液中混有少量 a 时,可通过降温结晶的方法 提纯 c
D.t2 ℃时,a、b 两种物质的饱和溶液降温到 t1℃,析出晶体较多的是 a
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学反应中,各物质质量随时间变化的曲线如图所示.其中说法一定正确的是( )
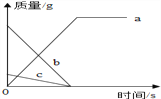
A.该反应是分解反应
B.物质c发生还原反应
C.物质b是化合物
D.物质a中元素种类等于b和c中元素种类之和
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列物质混合,经点燃充分反应后一定得到纯净物的是:
A. 质量比为4:7的氧气和一氧化碳B. 体积比为5:2的空气和氧气
C. 分子数比为1:2的甲烷和氧气D. 原子数比为4:1的氢气和氧气
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某粗盐样品中含有杂质硫酸钠、氯化钙。小林设计了以下提纯方案:
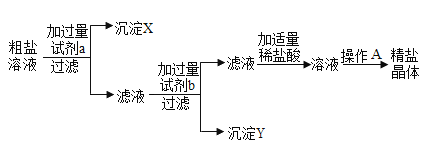
(1)试剂b的化学式是__
(2)操作过程中加适量稀盐酸时,可能发生的反应的化学方程式是_____
(3)若一次过滤后发现滤液仍浑浊,且滤纸未破损,需接着进行的操作是_
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】煤、石油、天然气并称为三大化石燃料。煤的综合利用是提高燃料利用率和降低对环境污染的有效方法之一、
(一)将煤制成水煤气(主要成分是氢气和一氧化碳)就是在高温下将煤与水蒸气发生反应生成水煤气(还含有少量的水蒸气和二氧化碳)。试写出工业上生产水煤气的化学方程式_____
(二)某课题组为验证水煤气的主要成分,作了如下准备:
1.收集信息:①H2+CuO![]() Cu+H2O;②CO+CuO
Cu+H2O;②CO+CuO![]() Cu+CO2
Cu+CO2
2.设计实验装置:
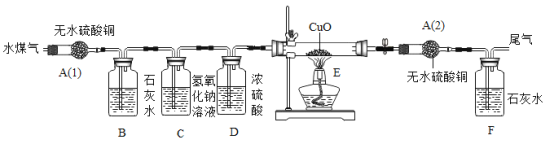
请分析上述信息和实验装置并回答下列问题:
①你认为验证水煤气中各成分的顺序依次是_____;
②装置C的目的是_____;装置D的作用是_____;
③装置E内观察到的现象是_____;
④实验中两次用到盛无水硫酸铜的装置,其目的分别是A(1)_____,A(2)_____;
⑤整个实验装置的设计有缺陷,是_____;
⑥若通入的水煤气总质量为3.2g,E中黑色粉末的质量减少了3.2g,该水煤气的有效成分的质量分数为_____。(计算结果保留1位小数)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】二氧化碳是重要的资源。
(1)植物生长离不开二氧化碳,有人说光合作用是地球上最伟大的化学变化,写出化学方程式_____。
(2)某同学对二氧化碳的某种性质作了如下探究:

如图所示,在C处放入用石蕊溶液染成紫色的干燥的纸花完成以下实验:在A处持续而缓缓地通入气体X。当关闭K时,C处的紫色石蕊纸花不变色;当打开K后,C处的紫色石蕊纸花变为红色。若气体X为未经干燥的二氧化碳,则B瓶中盛放的溶液可以为_____(填字母)。
A 浓硫酸
B 氢氧化钠溶液
C 饱和碳酸氢钠溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国科学家研究发现由CO2高效转化为甲醇(CH3OH)的新技术。该反应的微观过程如图所示,请推断出物质丁并回答下列问题:
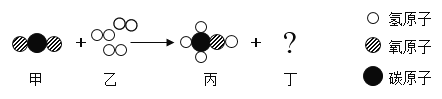
(1)上述甲→丁四种物质中属于氧化物的有________(填化学式).
(2)写出该反应的化学方程式__________________.
(3)类比乙醇的燃烧,写出甲醇在空气中完全燃烧的化学方程式_____________。
(4)若22gCO2全部转化为CH3OH,且反应中其它物质均不含碳元养,可生成CH3OH的______g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸钠用途非常广泛,是工业生产中重要的化工原料.在1921年我国科学家侯德榜创造了一种著名的纯碱生产方法﹣﹣“联合制碱法”.“联合制碱法”生产过程:
(1)第一步主要反应为NH3+CO2+H2O═NH4HCO3 该反应属于 反应基本反应类型.
(2)第二步用食盐与NH4HCO3反应.食盐来源于某盐田,该粗盐主要含有氯化钠,此外还含有少量硫酸钠,氯化钙和氯化镁.经净化、精制得到生产碳酸钠所需要的食盐水,其主要流程如图1:
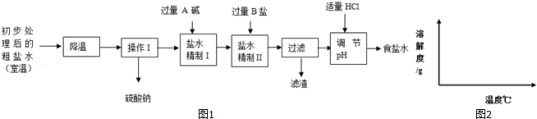
①通过降温使硫酸钠从粗盐水中析出,其原理是氯化钠和硫酸钠的溶解度与温度的变化差异较大,请在溶解度图(如图2)中简单画出氯化钠和硫酸钠的溶解度曲线变化趋势图.
②“精制I”操作中,加入过量含钙元素的碱的化学式是 .
其反应化学方程示为 .
③“精制II”操作中,加入B盐的有关反应方程式为 .
④为保证“精制II”操作中过量B盐把杂质全部除去,请在下表中写出检验溶液中B盐是否过量的实验报告.
实验操作 | 实验现象 | 实验结论 |
⑤查阅资料得知NaCl、NH4HCO3、NaHCO3、NH4Cl在30℃时的溶解度如下表所示:
温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
请根据溶解度表所提供的信息,写出“联合制碱法”中的第二步属于复分解反应的化学方程式: .
(3)第三步处理制得碳酸钠,反应原理为2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com