
【题目】实验小组做了如下图所示实验。
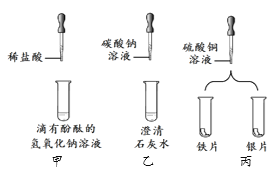
(1)能证明甲中发生反应的现象是________。
(2)乙中可观察到白色浑浊,则发生反应的化学方程式为________。
(3)丙中铁片上有红色固体析出,银片无明显变化。由该实验过程推断,金属活动性由强到弱为________。
【答案】溶液颜色由红色变为无色 ![]() Fe>Cu>Ag
Fe>Cu>Ag
【解析】
(1)氢氧化钠溶液显碱性,滴有酚酞溶液的氢氧化钠显红色,逐滴滴加稀盐酸,边滴加边搅拌,至溶液颜色由红色恰好变为无色,说明氢氧化钠已完全反应,即说明发生了反应。
(2)碳酸钠溶液能与氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:![]() 。
。
(3)丙中铁片上有红色固体析出,银片无明显变化,在金属活动性顺序中,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,说明铁的金属活动性比铜强,银的金属活动性比铜弱,即Cu>Ag;金属活动性由强到弱为Fe>Cu>Ag。
故答案为:
(1)溶液颜色由红色变为无色;
(2)![]() ;
;
(3)Fe>Cu>Ag。


科目:初中化学 来源: 题型:
【题目】硼及其化合物在工业上有很多用途。
(1)硼氢化钠(NaBH4)具有优良的还原性,在化学领域有着广泛的应用。利用硼精矿(主要成分为B2O3,含有少量Al2O3、SiO2、FeCl3等)制取NaBH4的流程如下图。
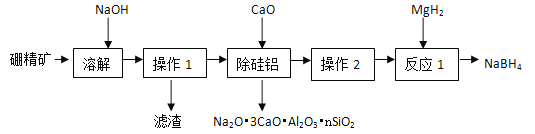
已知:①B2O3+2NaOH=2NaBO2+H2O;
②偏硼酸钠(NaBO2)易溶于水,不溶于醇,在碱性条件下稳定存在;
③Al2O3、SiO2均可与NaOH溶液反应生成可溶性钠盐。
回答下列问题:
(1)①操作1是____,滤渣主要成分为______(填化学式)。
②写出加快硼精矿溶解速率的措施(写一种)_______。
③除硅铝步骤加入CaO而不加入氯化钙的原因有:_____
I.能将硅、铝以沉淀除去;II.。
(2)单质硼可用于生成具有优良抗冲击性能硼钢,以硼酸(H3BO3)和金属镁为原料可以制备单质硼(B)。其制备过程先后通过两个化学反应,写出相关化学方程式:
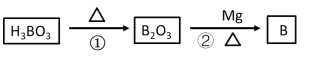
①分解反应____
②置换反应____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组同学发现实验台上整齐摆放的药品中(如图所示),有一试剂瓶的标签受损.
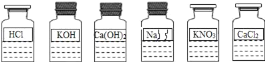
(提出问题)这瓶试剂的成分究竟是什么?
(讨论)根据受损标签及实验室药品分类摆放的原则,这瓶试剂不可能是_____.
A 酸 B 碱 C 盐.
(猜想)①可能是NaOH溶液;②可能是Na2CO3溶液;③可能_____.
(设计并实验)
(1)小明用洁净干燥的玻璃棒蘸取该溶液到湿润的pH纸上,测得其pH=10,他判断这是一种碱性溶液.对他的操作方法、测量结果及结论的评价,正确的是_____.
A 方法正确,结果准确,且结论正确.
B 方法正确,结果偏小,但结论正确.
C 方法不正确,结果偏大,但结论不正确.
D 方法正确,结果准确,但结论不正确.
(2)小明认为它是NaOH溶液,小俊认为它是Na2CO3溶液.要进一步确定它的成分,小俊认为只需选择如图所示已有的试剂就能鉴别出来.它们又进行了实验.
操作步骤 | 实验现象 | 结论及化学方程式 |
取样于试管中,_____ | _____ | _____ |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在学习盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液.同学们对该实验进行了一系列的研究.
探究一 M溶液中的溶质是什么?
(1)(提出猜想)该组同学认为M溶液的溶质有两种可能:①是 ,②是CaCl2.
(收集资料)CaCl2水溶液呈中性.
(2)(设计实验)同学们设计了如下方案并进行实验:
实验操作 | 实验现象 | 实验结论 |
取少量M溶液于试管中,向其中滴加 | | 猜想①正确,碳酸钠与其反应的化学方程式为 |
探究二 过滤后澄清滤液中会有哪些溶质?
(提出猜想)猜想一:NaOH和Na2CO3;猜想二:_____;猜想三:NaOH
(3)(实验验证)同学们针对“猜想一”进行了如下实验:
实验步骤 | 实验现象 | 实验结论 |
取样于试管中,滴入几滴稀盐酸 | 没有气体产生 | “猜想一”不成立 |
他们的实验结论是否正确? ,理由是 .
(4)(继续探究)设计实验方案确定滤液中溶质的组成.
实验操作 | 实验现象 | 实验结论 |
分别取少量滤液于A、B两支试管中,A中加入CaCI2溶液,B中加入 溶液 | 若A中产生白色沉淀,B中没有沉淀 | “猜想一”成立 |
| “猜想二”成立 | |
| “猜想三”成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】依据下列实验数据和溶解度曲线完成下面小题。
① | ② | ③ | ④ | |
温度 | 10℃ | 10℃ | 30℃ | 30℃ |
固体种类 | KNO3 | NaCl | KNO3 | NaCl |
固体质量 | 30g | 30g | 40g | 40g |
水的质量 | 100g | 100g | 100g | 100g |
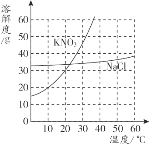
【1】①~④所得的溶液中,属于饱和溶液的是
A. ①和②B. ②和③C. ③和④D. ①和④
【2】下列说法中,正确的是
A. 溶质质量:①=②B. 溶液质量:②>③
C. 溶质质量分数:③>④D. 溶质与溶剂质量比:①=③
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】冬季冰雪覆盖路面,会给交通带来很多不便.
(1)为了疏通道路常使用铲雪车铲雪,铲雪车的铲斗是用锰钢制造的.
①锰钢的主要成分是Mn、C和_____.
②锰钢属于_____.
A 合成材料 B 合金 C 金属材料 D 化合物
(2)有一类融雪剂是以醋酸钾(CH3COOK)为主要成分的有机融雪剂.醋酸钾中钾元素的质量分数是_____(最后结果保留一位小数).
(3)还有一类融雪剂是以“氯盐”为主要成分的无机融雪剂,统称作“化冰盐”.常用工业碳酸钙(含有少量NaCl、FeCl3等杂质)为原料生产该融雪剂.主要生产流程如图所示.已知:Fe(OH)3为难溶的碱.

①“操作1”的名称是_____;溶液A中加入过量熟石灰,发生反应的化学方程式是_____.
②第二次加入盐酸的主要目的是_____.
③固体乙的成分是_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示.同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究.

提出问题:久置固体的成分是什么?
查阅资料:铁与氯化铁溶液在常温下发生反应生成氯化亚铁.
作出猜想:久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3.
实验探究:
甲同学的方案:
实验操作 | 实验现象 | 实验结论 |
取少量固体放于试管中,滴加足量的_____. | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液. | 固体中一定含有_____, 一定不含Fe2O3. |
乙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是_____.并设计如下实验方案继续验证.
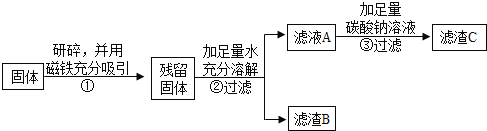
(1)②中固体溶解时放出大量热,由此可以判断固体中一定含有_____.
(2)③中反应的化学方程式是_____.
乙同学对滤渣B又进行探究.
实验操作 | 实验现象 | 实验结论 |
_____ | _____ | 固体中一定含有CaCO3 和Fe2O3. |
丙同学认为乙同学的方案中仍有一种物质不能确定.丙同学经过实验测得上述残留固体中含钙物质的总质量为1.6g,滤渣B中CaCO3的质量为1.0g,滤渣C的质量为1.0g.
综合上述实验及所给数据,久置固体的成分是_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】南海海域是我国固有领土,蕴藏着丰富的海洋资源。充分利用南海海洋资源,结合我国制碱工业先驱侯德榜发明的“侯氏制碱法”基本原理,模拟实现工业联合制取纯碱的过程如下(某些反应产物已略去):

请回答下列问题:
(1)操作a的名称是________;
(2)下列物质中均能与贝壳主要成分、生石灰、熟石灰发生反应的是________(填字母)。
A 水 B 盐酸 C 二氧化碳
(3)沉淀池中发生的反应是:NaCl+H2O+NH3+CO2══NaHCO3↓+NH4Cl。通常情况下,1L水能溶解约1L二氧化碳或700L氨气。现向精制饱和食盐水中通入两种气体的顺序是:先通氨气形成饱和氨盐水,然后在加压条件下通入二氧化碳。这样操作的目的是____________。
(4)已知:固体![]() ,Ca(HCO3)2和NaHCO3化学性质相似。写出反应④的化学方程式:___________;请列举小苏打在生活中的一种常见用途_________。
,Ca(HCO3)2和NaHCO3化学性质相似。写出反应④的化学方程式:___________;请列举小苏打在生活中的一种常见用途_________。
(5)仔细观察流程图,其中可循环利用的物质除二氧化碳之外,还有_________。
(6)联合制碱法生产的纯碱(Ⅲ类)国家质量主要标准如下表所示:
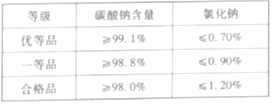
化学兴趣小组的同学设计并完成了如下实验来判断纯碱样品的等级(不考虑其他杂质参加反应)。称取10. 8g联合制碱法生产的纯碱样品,加入足量的水溶解,再加入足量的氯化钡溶液充分反应后过滤,将滤渣洗涤、干燥,得到碳酸钡固体19.7 g;另称取60 g联合制碱法生产的纯碱样品,加入足量的水溶解,再加入足量的硝酸银溶液和稀硝酸,充分反应后过滤,将滤渣洗涤、干燥,得到氯化银固体1.435 g。
①该纯碱样品中碳酸钠的质量分数为___________(计算结果精确到0.01%)
②列式计算该纯碱样品中所含氯化钠的质量分数______(计算结果精确到0.01%)
③该纯碱样品的等级为________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两物质的溶解度曲线如图所示。请据图回答:
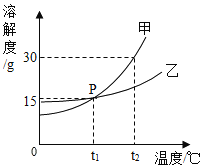
(1)P点的意义是_____;
(2)t2℃时,将20g的甲物质放入50g的水中,得到的是_____(填“饱和溶液“或“不饱和溶液”)。
(3)欲将接近饱和的乙溶液达到饱和,可采用的方法是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com