
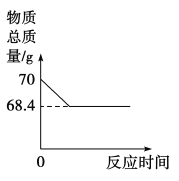
【题目】实验室用68g过氧化氢溶液和2g二氧化锰制取氧气,实验的相关数据如图。
请回答:
(1)二氧化锰作为催化剂在化学反应前后本身的______都没有发生变化;
(2)反应生成氧气的质量为________g。
(3)参加反应过氧化氢溶液的质量分数是____________?
【答案】 质量和化学性质 1.6 5%
【解析】本题考查了催化剂的特点和溶质质量分数与化学方程式相结合的计算。反应过程中质量的减少是因为生成了氧气,所以可以求算氧气的质量,根据氧气的质量和对应的化学方程式求算过氧化氢的质量。
(1)催化剂是在化学反应中能改变化学反应的速率,而本身的质量和化学性质不变的物质,二氧化锰作为催化剂在化学反应前后本身的质量和化学性质都没有发生变化;
(2)根据质量守恒,反应产生氧气的质量=70g-68.4g=1.6g;
(3)设:产生1.6g氧气需要H2O2的质量为x
2H2O2![]() 2H2O+O2↑
2H2O+O2↑
68 32
x 1.6g
![]() x=3.4g
x=3.4g
过氧化氢溶液的溶质质量分数=![]() ×100%=5%。
×100%=5%。


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:初中化学 来源: 题型:
【题目】同学们用碳酸钠溶液和浓盐酸来研究简易灭火器的反应原理时,对废液的成分进行了探究.
(推理假设)上述两种物质反应的化学方程式为 ______________________ .由此推测出反应后废液中的溶质一定有_______,可能有碳酸钠或盐酸.
(实验探究)
(一)确定废液中是否含有盐酸
(1)选择试剂:根据盐酸的化学性质,同学们选用了如图所示的五种物质,其中物质X是酸碱指示剂中的 ______ 溶液.
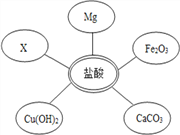
(2)实验验证:某同学甲向废液中加入少量的镁粉,观察到 __________ ,确定废液中一定没有盐酸.
(二)确定废液中是否含有碳酸钠
某同学选用 ______ 测出废液的pH=10,由此确定废液中_______________。
(三)处理废液,回收利用
欲从废液中得到纯净的NaCl,设计了如下实验方案,请完成方案评价.
方案 | 加入试剂 | 分离方法 | 方案评价 |
一 | 适量的Ca(NO3)2溶液 | 过滤、蒸发结晶 | ______ (选填“可行”或“不可行”,下同) |
二 | 适量的稀盐酸 | 蒸发结晶 | ______ |
查看答案和解析>>
科目:初中化学 来源: 题型:
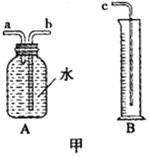
【题目】小敏研究影响锌与盐酸反应快慢的因素。
序号 | 盐酸溶液浓度 | 2分钟内产生氢气的体积 |
1 | 5% | 10mL |
2 | 15% | 28mL |
(1)图甲中A、B仪器可以组装一套测量气体体积的装置,利用该装置时A中的_____管接c。
(2)他选用2克完全相同的锌片分别和同体积5%、15%的稀盐酸进行实验。获得表格数据。由此推断实验是通过______来体现反应快慢的。
(3)小敏分析数据得到如下结论:锌与盐酸反应快慢与盐酸浓度有关,盐酸浓度越大反应越快。其他同学认为结论不可靠,他们的依据是:________。
(4)实验中小敏发现锌与盐酸反应时,一开始产生氢气速度并没有随盐酸浓度的减少而减慢,查阅资料得知化学反应中往往伴随着能量变化。由此作出猜想:锌与盐酸反应快慢还与_______有关。
查看答案和解析>>
科目:初中化学 来源: 题型:
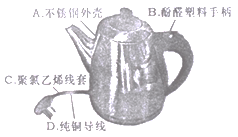
【题目】(1)下图是一种家用电热水壶,所用材料属于合金的是________ (填字母序号,下同),属于单质的是_______, 属于合成材料的是____;
(2)学习化学需要在宏观物质的性质与其微观结构之间建立联系。
1个CO2分子由_____构成。在氢氧化钠、氯化钠、硫酸三种物质中,由阴阳离子构成的是____,这三种物质的水溶液中pH<7的是______。
(3)A~G七种物质之间具有如下图所示转化关系。已知:A是一种含铁的矿石的主要成分,其中金属与非金属元素的原子个数比为1:2;B中铁的质量分数为70%;C是有刺激性气味的无色气体,它是形成酸雨的物质之一;F可溶于G的稀溶液并产生气体,该气体是有利于环境保护的理想燃料。请回答下列问题:

①A的化学式为______ ,已知A转化为B时金属元素的化合价升高,则A中非金属元素的化合价是____。
②B与CO反应的化学方程式是______________。
③C→D反应的化学方程式是________。
④B与G的稀溶液反应的化学方程式是________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,甲是溴(Br)的原子结构示意图,乙摘自元素周期表。下列说法正确的是
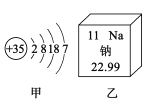
A. 甲元素属于金属元素
B. 甲、乙两种元素形成化合物的化学式是NaBr
C. 乙原子的核内中子数为11
D. 甲原子核外共有5个电子层
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为测定CuCl2和FeCl2组成的混合溶液中FeCl2的质量分数,进行如下实验:
①取200g混合溶液加入足量的AgNO3溶液,经过滤、洗涤、干燥、称量,得到143.5gAgCl固体;②另取原混合溶液各200g与含有杂质的废铁屑反应(杂质不溶于水,也不参与反应),共做了五组实验,其实验数据如下表。
实验组别 | 一 | 二 | 三 | 四 | 五 |
混合溶液质量/g | 200 | 200 | 200 | 200 | 200 |
铁屑质量/g | 6 | 9 | 12 | 15 | 18 |
析出铜的质量/g | 6.4 | 9.6 | m | 16 | 16 |
请分析计算:
(1)表中第三组实验的m值为_______。
(2)第_____组实验恰好完全反应。
(3)铁屑中铁的质量分数为多少___________?(计算结果精确到0.1%)
(4)原混合溶液中FeCl2的质量分数为多少______________?(计算结果精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学用如图装置验证质量守恒定律。称取一定质量的碳酸钠装入气球,将气球套在锥形瓶上。将药品全部倒入装有足量稀盐酸的锥形瓶中,气球迅速胀大。称量反应前后装置的总质量,实验数据如下表所示。

实验次数 | 1 | 2 | 3 |
碳酸钠质量/克 | 0.53 | 1.06 | 2.12 |
反应前装置总质量/克 | 66.33 | 66.86 | 67.92 |
反应后装置总质量/克 | 66.19 | 66.62 | 67.42 |
(1)计算第1次反应产生的二氧化碳质量为______________。
(2)分析数据发现每次反应前后装置的总质量均不相等,请以第1次反应为例,通过计算说明该反应是否遵循质量守恒定律______________。(空气密度取1.3克/升,二氧化碳密度取2.0克/升,结果精确到0.01)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铜元素有多种氧化物,如CuO、Cu2O.称取14.4g仅含Cu、O两种元素的固体样品、采用如下装置实验(夹持装置省略)。测得实验前后装置B增重4.4g。下列说法正确的是( )

A. 装置B的作用是吸收反应生成的H2O和CO2
B. 实验开始前应先关闭K2,打开K1,让CO通一段时间
C. 根据实验数据进行计算,可以确定该固体为Cu2O
D. 若缺少装置C,则实验所得Cu、O个数比偏高
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是元素周期表中提供的碘元素部分信息及碘原子结构示意图。下列说法错误的是

A. 碘单质(I2)是由碘原子直接构成的
B. 碘的相对原子质量为127,原子核内质子数为53
C. 碘原子核外共有53个电子,最外层有7个电子
D. 碘元素属于非金属元素,碘原子在化学反应中容易得到电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com