
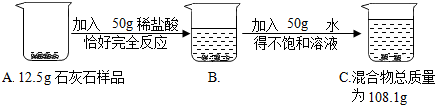
分析 (1)根据质量守恒定律,前后质量之差为生成的二氧化碳的质量,根据二氧化碳的质量可以计算出碳酸钙的质量;
(2)根据二氧化碳的质量可以计算出生成的氯化钙的质量,进而根据质量分数计算公式求质量分数.
解答 解:
(1)生成的二氧化碳的质量:12.5g+50g+50g-108.1g=4.4g;
(2)设碳酸钙的质量为x,生成氯化钙的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
x y 4.4g
$\frac{100}{x}=\frac{111}{y}=\frac{44}{4.4g}$
x=10g y=11.1g
样品中碳酸钙的质量分数为:$\frac{10g}{12.5g}$×100%=80.0%
(3)C烧杯中溶液中溶质的质量分数为:$\frac{11.1g}{10g+50g+50g-4.4g}$×100%=10.5%
答:
(1)4.4
(2)样品中碳酸钙的质量分数是80.0%
(3)C烧杯中溶液的溶质的质量分数是10.5%
点评 解决本题的关键是根据前后质量之差得出二氧化碳的质量,然后进行计算.


科目:初中化学 来源: 题型:选择题
| A. | 生活中纸张双面使用 | |
| B. | 绿色出行,骑行自行车上学 | |
| C. | 减少或不使用一次性木筷 | |
| D. | 为了促进工业发展,大力发展火力发电 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用水鉴别硫酸铜固体和氢氧化钠固体 | |
| B. | 用AgNO3溶液检验H2中混入的少量HCl气体 | |
| C. | 用Ba(OH)2溶液除去NaCl溶液中的Na2CO3杂质 | |
| D. | 用稀盐酸检验暴露在空气中的NaOH固体是否变质 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
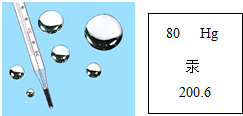 汞是银白色闪亮的重质液体,化学性质稳定,不溶于酸也不溶于碱.汞常温下即可蒸发,汞蒸发气和汞的化合物多有剧毒(慢性).汞使用的历史很悠久,用途很广泛,如图是汞在元素周期表中的相关信息,关于汞的说法正确的是( )
汞是银白色闪亮的重质液体,化学性质稳定,不溶于酸也不溶于碱.汞常温下即可蒸发,汞蒸发气和汞的化合物多有剧毒(慢性).汞使用的历史很悠久,用途很广泛,如图是汞在元素周期表中的相关信息,关于汞的说法正确的是( )| A. | 汞属于非金属元素 | |
| B. | 汞原子中质子与中子数之和为200.6 | |
| C. | 汞原子中电子数为80 | |
| D. | 汞不能与其他物质发生化学反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
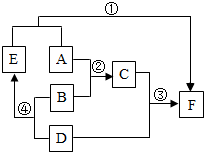 A、D均为黑色固体(D为常见金属)B为稀硫酸,D、E、F均为单质.如图为这些物质的转化关系,其中部分反应物、生成物、反应条件已省略.
A、D均为黑色固体(D为常见金属)B为稀硫酸,D、E、F均为单质.如图为这些物质的转化关系,其中部分反应物、生成物、反应条件已省略.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
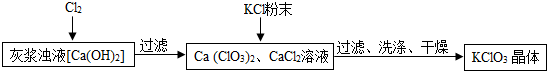
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com