
【题目】化学反应常伴随着能量的变化,从能量角度去认识化学变化是认识化学的重要手段。实验用品:37%的浓盐酸(密度为1.18g/mL)、10%的氢氧化钠溶液、蒸馏水量筒、温度计。
实验一:配制100mL 10%的盐酸(密度为1.05g/mL)
实验步骤:
(1)计算:需要37%的浓盐酸的体积为______mL(精确到0.01mL,下同):需要蒸馏水的体积为______mL(水的密度为10g/mL)
(2)量取浓盐酸和蒸馏水
(3)混合配制
实验二:在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸(室温下),反应中溶液温度的变化如下:
加入盐酸的体积(V)mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
溶液温度变化(△t)℃ | △t1 | 5.2 | 9.6 | 12.0 | 16.0 | 18.2 | 16.7 | 15.7 | 14.7 | 13.7 | 12.9 |
①表中△t1的值为______。
②写出该反应的化学方程式______。
③当加入盐酸的体积为10mL时,所得溶液的溶质一定含有______。
④根据上表分析,加入盐酸的体积在0~10mL,溶液温度变化的趋势及其原因是______。
⑤其他条件不变,若改用20%的盐酸进行滴加,结合对上述曲线的分析,大胆猜想新曲线最高点的位置(不考虑溶液密度和比热容的变化及热量散失等影响因素)______

【答案】24.05ml 76.62 0 NaOH+HCl=NaCl+H2O NaCl 溶液的温度不断升高,其原因是中和反应时放热反应 根据氢氧化钠和稀盐酸反应的方程式,浓度加倍溶质不变,体积应该减半
【解析】
(1)稀释前后溶质的质量不变,设需要37%的浓盐酸的体积为m,则37%×m×1.18g/mL=100mL×10%×1.05g/mL,解得m=24.05ml;水的质量为:100ml×1.05g/mL-24.05mL×1.18g/mL=76.62g,则水的体积=76.62ml÷1.0g/mL=76.62ml
(3)①反应还没进行,溶液的温度不变,所以是0;
②根据氢氧化钠和盐酸反应生成氯化钠和水,方程式为:NaOH+HCl=NaCl+H2O;
③氢氧化钠和稀盐酸反应,无论反应过量还是恰好完全反应,溶液中都会有氯化钠;
④根据表中数据可知,加入盐酸的体积在0~10mL,溶液的温度一直在增加,原因是氢氧化钠和稀盐酸反应属于中和反应,中和反应放出了热量,故填:溶液的温度不断升高,其原因是中和反应是放热反应;
⑤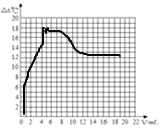
根据氢氧化钠和稀盐酸反应的方程式,浓度加倍溶质不变,体积应该减半。


科目:初中化学 来源: 题型:
【题目】下列实验不能达到目的是( )
A. 探究金属的活动顺序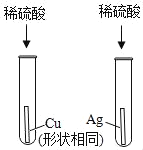
B. 测定空气中氧气的含量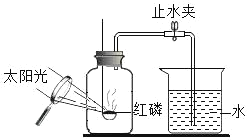
C. 证明CO2不能燃烧、不能支持燃烧,密度比空气大
D. 证明分子不断运动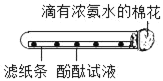
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了验证探究铁、铜、银的金属活动性强弱,设计了如图所示的两个实验。
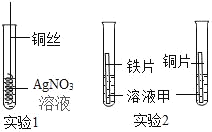
(1)实验1的目的是_____。其化学方程式是_____。
(2)实验2中,为了达到实验目的,溶液甲可以是_____或_____(写两种物质)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向一定量硝酸银和硝酸亚铁的混合溶液中加入锌粉,充分反应后所得溶液的质量与加入锌粉的质量关系如图。下列说法正确的是
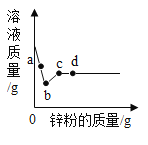
A.a点所得固体为银和铁
B.b点所得溶液中的溶质为硝酸银、硝酸亚铁和硝酸锌
C.c点所得固体为银、铁和锌
D.d点所得溶液中的溶质为硝酸锌
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质在反应前后的质量关系如下图所示,下列有关说法错误的是
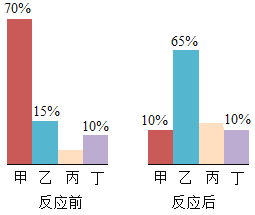
A. 反应前丙的质量分数为5%
B. 甲一定是化合物
C. 丁一定是催化剂
D. 该反应为分解反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用两圆相切表示两种物质可以发生反应,请回答下列问题:

(1)用两个圆形表示C(氢氧化钾溶液),D(硫酸铜溶液)两种物质,请将C,D两个圆画到图中A,B周围适当的位置,并标出物质名称。___
(2)写出发生中和反应的化学方程式_______。
(3)写出A,B反应的现象______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com