
【题目】碳酸镁水合物是制备镁产品的中间体。
Ⅰ.(制取MgCO33H2O)工业上从弱碱性卤水(主要成分为MgCl2)中获取MgCO33H2O的方法如图1:
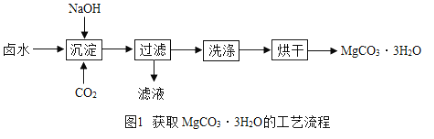
(1)沉淀过程得到了MgCO33H2O晶体和氯化钠的混合物,写出沉淀过程发生的化学反应方程式:________________________________________________。
(2)过滤需要用到的玻璃仪器有烧杯、玻璃棒和______,证明MgCO33H2O沉淀已洗涤干净的方法是,取最后一次洗涤液,_____________________________,说明已洗净。
(3)沉淀过程的溶液中镁离子含量随时间的变化如图3所示,不同温度下所得到沉淀产物如下表所示。

温度(℃) | 产物 |
46.95 | MgCO33H2O |
47.95 | MgCO33H2O |
48.95 | MgCO33H2O |
49.95 | Mg5(OH)2(CO3)44H2O |
则沉淀过程选择的温度为________,理由是此温度下,Mg2+沉淀的速率较快,沉淀效率较高,且不会生成其它沉淀。
Ⅱ.(测定MgCO33H2O的纯度)
(查阅资料)
a.碱石灰是CaO与NaOH的固体混合物。
b.MgCO33H2O+H2SO4=MgSO4+CO2↑+4H2O。
c.Mg5(OH)2(CO3)44H2O也可以表示为Mg(OH)24 MgCO34H2O,其相对分子质量为466,能与硫酸反应生成CO2。
(实验步骤)
利用如下图所示装置(图中夹持仪器略去)进行实验,以确定MgCO33H2O的纯度。
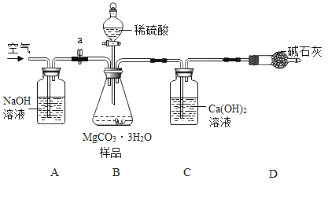

依据实验过程回答下列问题:
(1)实验结束后需持续缓缓通入空气,其作用为______________________________。
(2)C装置中反应生成CaCO3的化学方程式为_______________________;D中碱石灰的作用为_______________________________。
(3)下列各项措施中,能提高测定准确度的是_________(填标号)。
a在加入硫酸之前,应排净装置内的CO2气体
b为了缩短实验时间,快速滴加硫酸
c在B~C之间增添盛有浓硫酸的洗气装置
d在C装置左侧导管末端增添多孔球泡
e将C装置中澄清石灰水换成Ba(OH)2溶液
(4)实验中准确称取15.0g样品三份,进行三次测定,测得生成CaCO3沉淀的平均质量为10.0g。请计算样品中MgCO33H2O的纯度(写出计算过程)。______
(5)若获取MgCO33H2O的样品中含有少量Mg5(OH)2(O3)44H2O,则样品中MgCO33H2O的纯度___(填“偏大”“不变”或“偏小”)。
【答案】MgCl2+CO2+2NaOH+2H2O═MgCO33H2O↓+2NaCl 漏斗 加入硝酸银溶液,无沉淀产生 48.95℃ 使装置内残留的二氧化碳全部被C吸收 Ca(OH)2+CO2=CaCO3↓+H2O 防止空气中的二氧化碳和水进入C装置 a d e 92% 偏大
【解析】
根据给出的转化关系对应的过程分析每个对应的问题,或者直接分析每个问题,从给出的信息中找对应的信息。
(1)沉淀过程得到了MgCO33H2O晶体和氯化钠的混合物,反应物为氯化镁、二氧化碳以及氢氧化钠,结合质量守恒定律判断反应物有水,对应的化学反应方程式:MgCl2+CO2+2NaOH+2H2O═MgCO33H2O↓+2NaCl;
(2)过滤需要用到的玻璃仪器有烧杯、玻璃棒和 漏斗,证明MgCO33H2O沉淀已洗涤干净即表面没有附着的氯化钠,也就是检验氯离子,检验氯离子用硝酸银,具体的方法是,取最后一次洗涤液,加入硝酸银溶液,无沉淀产生,说明已洗净;
(3)根据给出的图和数据可知,沉淀过程选择的温度为 48.95℃,理由是此温度下,Mg2+沉淀的速率较快,沉淀效率较高,且不会生成其它沉淀;
[测定MgCO33H2O的纯度](1)实验结束后需持续缓缓通入空气,其作用为 使装置内残留的二氧化碳全部被C吸收,这样测量结果更准确;
(2)C装置中是二氧化碳和氢氧化钙反应生成水和CaCO3,对应的化学方程式为 Ca(OH)2+CO2=CaCO3↓+H2O;D中碱石灰的作用为 防止空气中的二氧化碳和水进入C装置;
(3)a、在加入硫酸之前,应排净装置内的CO2气体,避免本身存在的二氧化碳的造成的干扰,故正确;
b、为了缩短实验时间,快速滴加硫酸,导致二氧化碳可能来不及和氢氧化钙反应而逸出,故错误;
c、在B~C之间增添盛有浓硫酸的洗气装置,排除了水,但是由于实验关注的是沉淀的质量,而 水的存在不影响碳酸钙的质量,所以没有必要,故错误;
d、在C装置左侧导管末端增添多孔球泡,利于二氧化碳与氢氧化钙的反应,提高了吸收效果,故正确;
e、将C装置中澄清石灰水换成Ba(OH)2溶液,这样测量误差会更小,利于提高测量的准确度,故正确;
(4)设样品中MgCO33H2O的纯度为 x,
由MgCO33H2O+H2SO4=MgSO4+CO2↑+4H2O和Ca(OH)2+CO2=CaCO3↓+H2O可得关系式为:
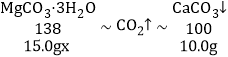
![]()
x=92%;
(5)若获取MgCO33H2O的样品中含有少量Mg5(OH)2(CO3)44H2O,其含碳量为![]() ×100%≈10.3%,而MgCO33H2O含碳量为
×100%≈10.3%,而MgCO33H2O含碳量为![]() ×100%≈8.7%,杂质的含碳量高于MgCO33H2O,所以根据实验原理会导致样品中MgCO33H2O的纯度偏大。
×100%≈8.7%,杂质的含碳量高于MgCO33H2O,所以根据实验原理会导致样品中MgCO33H2O的纯度偏大。


科目:初中化学 来源: 题型:
【题目】现有盐酸和CaCl2的混合溶液,向其中逐滴滴入Na2CO3溶液,生成沉淀质量与滴入Na2CO3溶液质量的变化关系如右图所示。下列说法错误的是
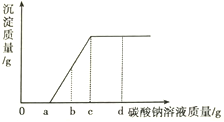
A. 滴加碳酸钠溶液质量为a~c克时,溶液中发生的反应为CaCl2+Na2CO3=2NaCl+CaCO3↓
B. 滴加碳酸钠溶液质量至b克时,溶液中含有三种溶质
C. 滴加碳酸钠溶液质量至a克时,溶液质量比原混合溶液质量大
D. 滴加碳酸钠溶液质量至c克时,溶液呈中性
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是![]()
![]()
A | B | C | D | |
实 验 装 置 |
硫在氧气中燃烧 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
排水法收集氢气 |
解释 | 集气瓶中的水: 吸收有害气体 | 量筒中的水: 通过水体积的变化得出 | 集气瓶中的水: 吸收溅落融熔物 | 集气瓶中的水: 水先将集气瓶内的空气排净,后便于观察 |
A. A B. B C. C D. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】同学们在教材中看到了下面的图示,想到了用天然气烧水,于是整合了火力发电和烧水的流程如下图,试回答下列问题。
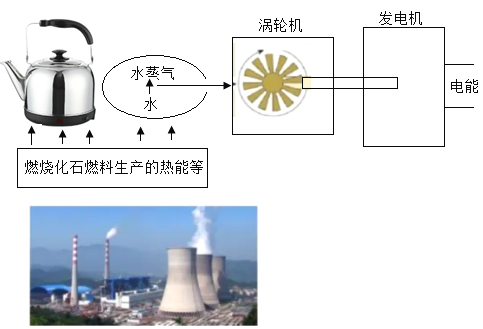
(1)烧煤发电(火力发电)时的能量转化是_____;
(2)烧水的水壶最好使用的材料是(____)
A 焊锡
B 钛合金
C 不锈钢
D 生铁
(3)含锡(Sn)的矿石主要是锡石,主要成分为二氧化锡,锡的冶炼可以用焦炭高温还原锡石,写出用焦炭炼锡的化学方程式_____,反应过程中锡元素的化合价变化为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】NaCl是重要的资源,其应用与生产如下图所示。下列说法不正确的是
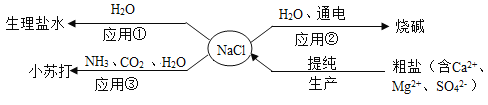
A.应用①操作的主要步骤为:计算、称量、溶解、装瓶、贴标签
B.应用②在制备烧碱的过程中,水参与了反应
C.应用③为提高产率应先通NH3,再通CO2,制备过程中还能得到一种化肥
D.生产中提纯粗盐时可依次加入过量的BaCl2、NaOH、Na2CO3溶液,再过滤、蒸发
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】能源的利用与社会可持续发展密切相关。
(1)煤燃烧时产生NO2、_____等气体,这些气体或气体在空气中发生反应后的生成物溶于雨水,会形成酸雨。
(2)“低碳”是一种生活理念,也是一种生活态度。下列做法中不符合“低碳”要求的是_____
A 节约纸张
B 大量使用化石燃料
C 提倡使用节约技术和节能产品
D 尽量乘坐公交车
(3)在高温下,工业上以赤铁矿(主要成分是Fe2O3)和一氧化碳反应来炼铁的化学方程式为_____。
(4)在一定条件下,甲烷(CH4)和水反应(未配平)的微观示意图如图所示。
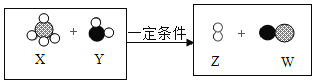
该反应中两种生成物Z和W的分子个数比为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】学习化学能培养我们的学科素养,下列说法不正确的是
A.变化与守恒:2NaCl + 2H2O![]() 2X + Cl2↑+ H2↑中,X 的化学式是 NaOH
2X + Cl2↑+ H2↑中,X 的化学式是 NaOH
B.模型与推理:活泼金属与稀盐酸反应有气体产生,则与稀盐酸反应有气体生成的一 定是活泼金属
C.宏观与微观:活性炭可以使红墨水褪色,原因是它具有疏松多孔的结构
D.实验与探究:往水样中加入肥皂水后振荡,出现较多泡沫,说明该水样是软水
查看答案和解析>>
科目:初中化学 来源: 题型:
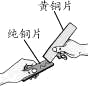
【题目】金属在生产、生活中应用广泛。
(1)一氧化碳还原氧化铁的方程式为__________________。冶炼 16t 氧化铁,可得到铁_______t。
(2)铝抗腐蚀性能好,是因为铝与氧气反应,在其表面生成一层致密的氧化铝薄膜,氧化铝的化学式为_______________。
(3)黄铜是铜锌合金,将纯铜片和黄铜片相互刻画(如图所示),纯铜片上留下明显的划痕,该实验的目的是_____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图像不能正确反映其对应关系的是

A.加热一定质量的高锰酸钾
B.向含有HCl和CaCl2的混合溶液中加入Na2CO3溶液
C.向等质量等质量分数的稀盐酸中分别加入过量的锌和铁
D.将一瓶浓硫酸敞口放置在空气中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com