
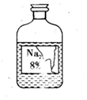
 化学兴趣小组的同学发现试验台上一瓶标签残缺的无色溶液(如图所示),他们提出可能是Na2SO4、NaHCO3、Na2CO3溶液中的一种,于是决定对这瓶溶液进行实验探究.
化学兴趣小组的同学发现试验台上一瓶标签残缺的无色溶液(如图所示),他们提出可能是Na2SO4、NaHCO3、Na2CO3溶液中的一种,于是决定对这瓶溶液进行实验探究.| 溶液 | Na2SO4 | NaHCO3 | Na2CO3 |
| pH | pH=7 | pH>7 | pH>7 |
| 实验步骤 | 现象 | 结论 |
| ①取该溶液少许于试管中,滴加过量的BaCl2溶液,振荡. | 产生白色沉淀 | 该溶液是Na2CO3溶液 |
| ②继续滴加过量稀盐酸,振荡 | 白色沉淀全部溶解,产生气泡 |
分析 (1)该溶液不可能是NaHCO3,这是因为NaHCO3中,钠原子右下角是1,而标签残缺的无色溶液中,钠原子右下角是2;
(2)根据实验现象可以判断实验结论,根据实验结论可以判断实验现象;
(3)硫酸钠不能和稀盐酸反应,碳酸钠能和稀盐酸反应生成氯化钠、水和二氧化碳;
硫酸钠溶液显中性,不能使酚酞试液变色,碳酸钠溶液显碱性,能使酚酞试液变红色;
(4)为防止标签被腐蚀,倾倒液体时标签应该向着手心,以防液体下流时腐蚀标签.
解答 解:(1)该溶液不可能是NaHCO3,这是因为NaHCO3中,钠原子右下角是1,而标签残缺的无色溶液中,钠原子右下角是2.
故填:NaHCO3.
(2)①取该溶液少许于试管中,滴加过量的BaCl2溶液,振荡,产生白色沉淀;
②继续滴加过量稀盐酸,振荡,白色沉淀全部溶解,产生气泡,说明该溶液是Na2CO3溶液,实验过程如下表所示:
| 实验步骤 | 现象 | 结论 |
| ①取该溶液少许于试管中,滴加过量的BaCl2溶液,振荡. | 产生白色沉淀 | 该溶液是Na2CO3溶液 |
| ②继续滴加过量稀盐酸,振荡 | 白色沉淀全部溶解,产生气泡 |
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 药品 | 杂质 | 试剂 | 操作 |
| A | NaCl溶液 | Na2CO3 | 过量BaCl2溶液 | 结晶 |
| B | CO2 | CO | 过量氢氧化钠溶液 | 干燥 |
| C | FeCl2溶液 | CuCl2 | 过量铁粉 | 过滤 |
| D | CaO固体 | CaCO3 | 足量的水 | 蒸发 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 电子数:Fe2+>Fe3+ | B. | 含铁量:Fe2O3>FeO | ||
| C. | 地壳中元素含量:Fe>Al | D. | 水中溶解能力:O2>CO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 催化剂就是二氧化锰 | |
| B. | 催化剂能降低物质的化学反应速度 | |
| C. | 在化学反应前后催化剂的状态没有改变 | |
| D. | 催化剂可以使反应物进行反应且反应前后化学性质没有改变 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀时的pH | 2.3 | 4.0 | 开始溶解:7.8 |
| 完全沉淀时的pH | 3.7 | 5.2 | 完全溶解:10.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | SO42-、Na+、CO32- | B. | Fe3+、SO42-、Cl- | C. | Mg2+、Cl-、OH- | D. | Na+、Ba2+、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com